题目内容
10.已知: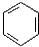 +CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$
+CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$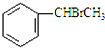 +H2O(卤烷基化反应)
+H2O(卤烷基化反应) +R′-X$\stackrel{一定条件}{→}$
+R′-X$\stackrel{一定条件}{→}$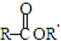 +NaX
+NaX用苯为原料合成化合物Ⅳ的线路如下:
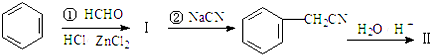 $\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)
$\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)其中:Ⅱ是羧酸.请回答下列问题:
(1)②的反应类型是取代反应.
(2)写出同时符合下列条件的化合物Ⅱ的同分异构体结构简式(写2种)
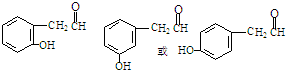 .
.a.能与FeCl3溶液作用显紫色,
b.能发生银镜反应,
c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为1:2:1.
(3)1mol化合物Ⅳ完全燃烧消耗O217.5mol,化合物Ⅳ的结构简式是
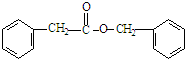 .
.(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式
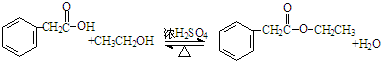 .
.(5)①也与卤烷基化反应,写出该反应的化学方程式
 .
.
分析 由题可知①反应为苯与甲醛发生卤烷基化反应,故产物I为 ,②与NaCN发生取代反应产物为
,②与NaCN发生取代反应产物为 ,在酸性条件下与水反应产物为Ⅱ
,在酸性条件下与水反应产物为Ⅱ ,与碱中和反应产物为Ⅲ
,与碱中和反应产物为Ⅲ ,后与
,后与 发生取代反应生成产物Ⅳ
发生取代反应生成产物Ⅳ ,
,
据此分析解答.
解答 解:由题可知①反应为苯与甲醛发生卤烷基化反应,故产物I为 ,②与NaCN发生取代反应产物为
,②与NaCN发生取代反应产物为 ,在酸性条件下与水反应产物为Ⅱ
,在酸性条件下与水反应产物为Ⅱ ,与碱中和反应产物为Ⅲ
,与碱中和反应产物为Ⅲ ,后与
,后与 发生取代反应生成产物Ⅳ
发生取代反应生成产物Ⅳ ,
,
(1)通过以上分析知,②反应类型为取代反应,故答案为:取代反应;
(2)化合物Ⅱ的同分异构体,要求a.能与FeCl3溶液作用显紫色,故该物质具有酚的结构,b.能发生银镜反应,具有全的结构,c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为1:2:1,故结构中含一羟基、一醛基、一亚甲基;故同分异构体为 ,
,
故答案为: ;
;
(3)化合物Ⅳ化学式为C15H14O2,故1mol化合物Ⅳ完全燃烧消耗O2 物质的量=(15+$\frac{14}{4}$-$\frac{2}{2}$)mol=17.5mol,IV的结构简式为 ,
,
故答案为:17.5;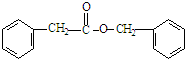 ;
;
(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式为: ,
,
故答案为: ;
;
(5)①也是卤烷基化反应,写出该反应的化学方程式 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,明确官能团及其性质关系是解本题关键,根据反应条件结合题给信息进行推断,题目难度中等.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
20.下列叙述中,说法不正确的是( )
| A. | 复分解反应一定都不属于氧化还原反应 | |
| B. | 在氧化还原反应中,反应物中的金属单质不一定是还原剂 | |
| C. | 在氧化还原反应中,非金属单质不一定是氧化剂 | |
| D. | 置换反应一定都属于氧化还原反应 |
1.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | lmol Na2O2晶体中共含有2NA个离子 | |
| B. | 0.1 molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| C. | 常温常压下16gO2和O3混合气体含有NA个氧原子 | |
| D. | 电解精炼铜时每转移NA个电子,阳极生成氧气 |
5.结合下图判断,下列叙述正确的是( )
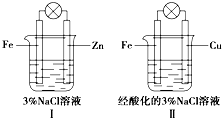

| A. | Ⅰ和Ⅱ中正极均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| D. | Ⅰ和Ⅱ中灯泡均会发亮 |
15.某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,且原子序数依次增大,Y、Z处于相邻主族,Y、W为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.则下列判断正确的是( )
| A. | Y、Z的氧化物都有两性 | |
| B. | 气态氢化物的稳定性:Z>X | |
| C. | 原子半径:W>Y>Z>X | |
| D. | 最高价氧化物对应水化物的碱性:W<Y |
2.氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业.氯化亚铜(CuCl)是一种白色粉末,微溶于水、不溶于乙醇、稀硝酸及稀硫酸;可溶于氨水、浓盐酸,并生成配合物NH4[CuCI2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图1是实验室制备氯化亚铜的流程图及实验装置图如图2.

实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36qo盐酸15mL、水.
(1)反应①的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分.
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生02的速率,宜选择图3中的B(填字母序号)方案.
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是氯化铵溶于水吸收大量热量;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞,沿a或c(填字母)口倾出棕色反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题有防止CuCl被氧化,避光防止分解.
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0mol.L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表.
(已知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+═Fe3++Ce3+)
④数据处理:计算得CuCI的纯度为95%(平行实验结果相差不能超过0.3%)

实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36qo盐酸15mL、水.
(1)反应①的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分.
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生02的速率,宜选择图3中的B(填字母序号)方案.
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是氯化铵溶于水吸收大量热量;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞,沿a或c(填字母)口倾出棕色反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题有防止CuCl被氧化,避光防止分解.
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0mol.L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表.
(已知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+═Fe3++Ce3+)
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.65 | 24.75 | 24.70 |
19.下列说法正确的是( )
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |

 .
.