题目内容
下列事实与胶体性质无关的是( )
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |
考点:胶体的重要性质
专题:
分析:A.胶粒不能透过半透膜;
B.电解质溶液使泥沙胶粒聚沉;
C.植物油、水的混合物属于乳浊液;
D.蛋白质溶液是胶体,胶体能产生丁达尔效应.
B.电解质溶液使泥沙胶粒聚沉;
C.植物油、水的混合物属于乳浊液;
D.蛋白质溶液是胶体,胶体能产生丁达尔效应.
解答:
解:A.淀粉溶液是胶体,胶粒不能透过半透膜,可用渗析提纯胶体,故A错误;
B河流中的水含有泥沙胶粒,海水中含有氯化钠、氯化钙等电解质,二者相遇是可以发生胶体凝聚,就形成三角洲,与胶体有关,故B错误;
C.植物油、水的混合物属于乳浊液,不属于胶体,故C正确;
D.蛋白质溶液是胶体,胶体能产生丁达尔效应,所以与胶体有关,故D错误.
故选C.
B河流中的水含有泥沙胶粒,海水中含有氯化钠、氯化钙等电解质,二者相遇是可以发生胶体凝聚,就形成三角洲,与胶体有关,故B错误;
C.植物油、水的混合物属于乳浊液,不属于胶体,故C正确;
D.蛋白质溶液是胶体,胶体能产生丁达尔效应,所以与胶体有关,故D错误.
故选C.
点评:本题考查胶体的性质,明确胶体常见的性质有丁达尔现象、胶体的聚沉、电泳等,题目难度不大.

练习册系列答案
相关题目
下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是( )
| A、Na+、Ca2+、SO42-、Cl- |
| B、H+、Mg2+、CO32-、S2- |
| C、K+、Mg2+、SO42-、NO3- |
| D、K+、Na+、NO3-、SO32- |
根据下列化学方程式,判断有关物质的还原性强弱的顺序为( )
①I2+SO2+2H2O═H2SO4+2HI;
②2FeCl2+Cl2═2FeCl3;
③2FeCl3+2HI═2FeCl2+2HCl+I2.
①I2+SO2+2H2O═H2SO4+2HI;
②2FeCl2+Cl2═2FeCl3;
③2FeCl3+2HI═2FeCl2+2HCl+I2.
| A、I->Fe2+>Cl->SO2 |
| B、Cl->Fe2+>SO2>I- |
| C、Fe2+>I->Cl->SO2 |
| D、SO2>I->Fe2+>Cl- |
根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
下列叙述错误的是( )
| A、标准状况下,5LCH4气体与5LNH3气体的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5×6.02×1023个 |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度 |
| D、同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11 |
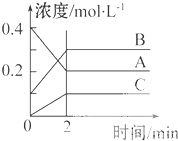 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A、发生的反应可表示为:2A(g)?2B(g)+C(g) |
| B、前2 min A的分解速率为0.1mol?L-1?min-1 |
| C、开始时,正逆反应同时开始 |
| D、2 min时,A、B、C的浓度之比为2:3:1 |

 (1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为