题目内容
根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
考点:化学方程式的有关计算
专题:
分析:根据题意知,酸性条件下,NaClO3和Na2SO3发生氧化还原生成ClO2和Na2SO4,同时生成水,该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,根据转移电子相等配平方程式,从而确定NaClO3和Na2SO3的物质的量之比.
解答:
解:根据题意知,酸性条件下,NaClO3和Na2SO3发生氧化还原生成ClO2和Na2SO4,同时生成水,该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,其转移电子数为2,根据转移电子相等配平方程式为H2SO4+2NaClO3+Na2SO3=2Na2SO4+2ClO2+H2O,所以该反应中NaClO3和Na2SO3的物质的量之比为2:1,
故选B.
故选B.
点评:本题目考查学生氧化还原反应中的电子守恒定律,可以根据所学知识来灵活运用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知化学反应A2(g)+B2(g)═2AB(g)△H=Q kJ?mol-1,其能量变化如图所示,则Q的值正确的是( )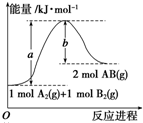

| A、a-b | B、a | C、-b | D、b-a |
某元素在化学反应中由化合态变为游离态,则该元素( )
| A、一定被氧化 |
| B、一定被还原 |
| C、可能被氧化也可能被还原 |
| D、既没被氧化也没被还原 |
下列事实与胶体性质无关的是( )
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |
决定一定物质的量的气体体积大小的主要因素有( )
| A、气体分子的直径 |
| B、气体分子的数目 |
| C、气体分子间距离 |
| D、气体分子的相对分子质量 |
下列有关实验操作的说法正确的是( )
| A、中和反应反应热的测定实验中,用温度计测完盐酸的温度后,直接继续测量NaOH溶液的温度 |
| B、中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铁丝搅拌棒,不影响反应热的测定 |
| C、用50ml酸式滴定管可准确量取25.00mlKMnO4溶液 |
| D、用PH试纸测定溶液的PH时,需先用蒸馏水润湿试纸 |