题目内容
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
4FeS2+11O2
8 SO2+Fe2O3
,该反应中被氧化的元素是 (填元素符号).
当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L.
(2)实验室中用如图1装置测定SO2催化氧化为SO3的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
①:实验过程中,需要通入氧气.试写出一个用如图2装置制取氧气的化学方程式 .
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 .
③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简).
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.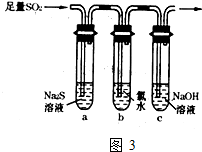
①能说明二氧化硫具有氧化性的实验现象 .
②为验证二氧化硫的还原性,充分反应后取试管b中的溶液分成三份,
分别进行如下实验:方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”); 试管b中发生反应的离子方程式为 .
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
4FeS2+11O2
| ||
,该反应中被氧化的元素是
当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为
(2)实验室中用如图1装置测定SO2催化氧化为SO3的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)

①:实验过程中,需要通入氧气.试写出一个用如图2装置制取氧气的化学方程式
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.

①能说明二氧化硫具有氧化性的实验现象
②为验证二氧化硫的还原性,充分反应后取试管b中的溶液分成三份,
分别进行如下实验:方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
考点:二氧化硫的化学性质,含硫物质的性质及综合应用,制备实验方案的设计
专题:氧族元素
分析:(1)氧化还原反应中,化合价升高的元素在反应中被氧化,根据电子守恒确定转移电子的量与二氧化硫的量之间的关系;
(2)①氯酸钾受热分解可以获得氧气;
②为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确;
③根据质量守恒以及转化率=
×100%来计算;
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
②氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸;
(2)①氯酸钾受热分解可以获得氧气;
②为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确;
③根据质量守恒以及转化率=
| 转化为三氧化硫的二氧化硫的量 |
| 二氧化硫的总量 |
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
②氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸;
解答:
解:(1)氧化还原反应4FeS2+11O2
8SO2+2Fe2O3中,化合价升高的Fe、S元素在反应中被氧化,该反应生成8mol的二氧化硫,转移电子的物质的量为44mol,所以当该反应转移2.75mol电子时,生成的二氧化硫的物质的量为0.5mol,在标准状况下的体积为11.2L,故答案为:Fe、S;11.2;
(2)①氯用图2所示装置制取氧气,即加热固体的方法制氧气,可以让氯酸钾在二氧化锰催化下受热分解获得氧气,方程式为:2KClO3
2KCl+3O2↑,
故答案为:2KClO3
2KCl+3O2↑;
②为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确,当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,可以让装置中的二氧化硫和三氧化硫充分被后面的装置吸收,故答案为:使残留在装置中的二氧化硫和三氧化硫被充分吸收;
③装置D增加的质量为mg,及生成三氧化硫的质量是mg,物质的量是
,装置E中产生白色沉淀的质量为ng,则吸收的二氧化硫的物质的量是
,则二氧化硫的转化率=
×100%;
故答案为:
×100%;
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:试管a中出现淡黄色浑浊;
②方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液汇总出现硫酸根离子,是二氧化硫在酸性环境下和氯水反应生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,故答案为:Ⅲ;SO2+Cl2+2H2O=4H++SO42-+2Cl-;
| ||
(2)①氯用图2所示装置制取氧气,即加热固体的方法制氧气,可以让氯酸钾在二氧化锰催化下受热分解获得氧气,方程式为:2KClO3
| ||
| △ |
故答案为:2KClO3
| ||
| △ |
②为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确,当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,可以让装置中的二氧化硫和三氧化硫充分被后面的装置吸收,故答案为:使残留在装置中的二氧化硫和三氧化硫被充分吸收;
③装置D增加的质量为mg,及生成三氧化硫的质量是mg,物质的量是
| mg |
| 80g/mol |
| ng |
| 233g/mol |
| ||||
|
故答案为:
| ||||
|
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:试管a中出现淡黄色浑浊;
②方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液汇总出现硫酸根离子,是二氧化硫在酸性环境下和氯水反应生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,故答案为:Ⅲ;SO2+Cl2+2H2O=4H++SO42-+2Cl-;
点评:本题考查了二氧化硫性质应用和实验验证,实验设计的步骤和实验方案的确定应根据题干要求分析判断,关键是读懂题干信息,依据题干条件计算判断,题目较难.

练习册系列答案
相关题目
已知化学反应A2(g)+B2(g)═2AB(g)△H=Q kJ?mol-1,其能量变化如图所示,则Q的值正确的是( )

| A、a-b | B、a | C、-b | D、b-a |
在25℃和1.01×105Pa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
| A、是吸热反应 |
| B、是放热反应 |
| C、是熵减反应 |
| D、是熵增效应大于能量效应 |
下列事实与胶体性质无关的是( )
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |