题目内容
12.化学与生活、社会发展息息相关,下列有关说法不正确的是( )| A. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的物质是葡萄糖 | |
| B. | 制造新版人民币所用的棉花,优质针叶木等原料的主要成分是纤维素 | |
| C. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,属于物理变化 |
分析 A.淀粉遇碘变蓝色;
B.棉花和优质针叶木的成分都是纤维素;
C.合金的硬度大于其任一成分;
D.没有新物质生成的变化属于物理变化.
解答 解:A.淀粉遇碘变蓝色为淀粉的特征反应,葡萄糖和碘不反应,故A错误;
B.棉花和树木、树叶都成分都是纤维素,纤维素属于高分子化合物,故B正确;
C.剑刃硬度要大,所以用碳铁合金,故C正确;
D.“青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,该提取过程中没有新物质生成,属于物理变化,故D正确;
故选A.
点评 本题考查物质性质、物质成分、物质变化等知识点,为高频考点,明确物质组成、性质、用途关系是解本题关键,会根据物质性质解释其用途,题目难度不大.

练习册系列答案
相关题目
8.若烃(CxH2x-6)符合下列两个条件,则烃(CxH2x-6)的一氯代物共有(不考虑立体异构)( )
①1个CxH2x-6分子中碳与氢原子之间形成8个共价键
②烃(CxH2x-6)中含一个苯环.
①1个CxH2x-6分子中碳与氢原子之间形成8个共价键
②烃(CxH2x-6)中含一个苯环.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
17.在0.1mol/LNa2CO3溶液中,下列判断正确的是( )
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-) | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) |
14.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
则:
(1)硝酸的浓度为多大?
(2)每份金属的质量为多少?
(3)编号④中最多产生的气体积V为多少升?(该问答案取整数)
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 12.2 | 3.2 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
(1)硝酸的浓度为多大?
(2)每份金属的质量为多少?
(3)编号④中最多产生的气体积V为多少升?(该问答案取整数)
7.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
17.下列有关物质性质的应用不正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 次氯酸具有强氧化性,因此氯气可用于自来水的杀菌消毒 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
4.下列反应的离子方程式书写正确的是( )
| A. | (NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH-=NH3•H2O | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 用烧碱溶液吸收氯气:Cl2+OH-=Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- |
1.表是元素周期表的一部分,回答下列有关问题:
(1)画出原子的结构示意图:④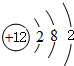 ,⑧
,⑧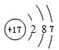
(2)第三周期(除稀有气体元素)中原子半径最大的元素是③(填序号),跟它同周期原子半径最小的元素是⑧(填序号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)写出实验室制取元素①的气态氢化物最常用的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)元素①的最高价氧化物对应的水化物的浓溶液与单质铜反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
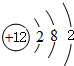 ,⑧
,⑧
(2)第三周期(除稀有气体元素)中原子半径最大的元素是③(填序号),跟它同周期原子半径最小的元素是⑧(填序号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)写出实验室制取元素①的气态氢化物最常用的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)元素①的最高价氧化物对应的水化物的浓溶液与单质铜反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
2.短周期主族元素X,Y,Z,W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X,Y的核电荷数之比为3:4,W-的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是( )
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小:X<Y,Z>W | |
| C. | 化合物Z2Y和ZWY3都只存在离子键 | |
| D. | Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |