题目内容
8.若烃(CxH2x-6)符合下列两个条件,则烃(CxH2x-6)的一氯代物共有(不考虑立体异构)( )①1个CxH2x-6分子中碳与氢原子之间形成8个共价键
②烃(CxH2x-6)中含一个苯环.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 烃(CxH2x-6)中含一个苯环,分析可知为苯的同系物,1个CxH2x-6分子中碳与氢原子之间形成8个共价键,含有8个氢原子,2x-6=8,x=7,则分子式为C7H8,结合苯环结构得到该物质为甲苯,一氯取代物在甲基上一种,苯环上邻间对三种;
解答 解:依据题干信息可知,烃(CxH2x-6)中含一个苯环,符合此通式的烃为苯的同系物,1个CxH2x-6分子中碳与氢原子之间形成8个共价键,含有8个氢原子,2x-6=8,x=7,则分子式为C7H8,结合苯环结构得到该物质为甲苯,一氯取代物在甲基上一种,苯环上邻间对三种,一氯代物共有4种,
故选C.
点评 本题考查了有机物结构的分析判断,同分异构体存在的分析,注意通式的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
19.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.
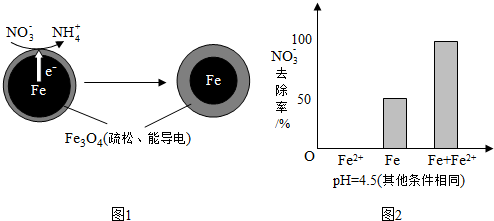
(1)Fe还原水体中NO3-的反应原理如图1所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时,NO3-的去除率低.其原因是FeO(OH)不导电,阻碍电子转移.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如表:
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.

(1)Fe还原水体中NO3-的反应原理如图1所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 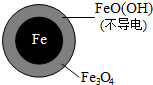 |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
16.下列说法正确的是( )
| A. | 煤的气化是物理变化 | |
| B. | 蛋白质的基本结构单元是氨基酸 | |
| C. | 在蛋白质溶液中加入CuSO4溶液,可使蛋白质的溶解度降低而析出 | |
| D. | 乙醛、葡萄糖、淀粉都能与新制的银氨溶液发生反应 |
1.如图为常温下向25mL0.1mol•L-1 MOH溶液中逐滴滴加0.2mol•L-1 HCl溶液过程中溶液pH的变化曲线,下列推断正确的是( )
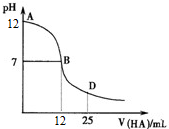

| A. | MOH在水中的电离方程式是MOH═M++OH- | |
| B. | 在B点表示酸碱恰好中和 | |
| C. | 随着盐酸的加入,溶液的导电能力逐渐增强(忽略体积变化) | |
| D. | 在D点时,存在c(OH-)>c(Na+)>c(Cl-)>c(M+) |
8.苯乙烯与溴的四氯化碳溶液反应产物的同分异构体中满足苯环上只有1种氢原子的结构有( )
| A. | 3种 | B. | 4种 | C. | 7种 | D. | 9种 |
5.下列叙述不正确的是( )
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 | |
| C. | 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管加蒸馏水至刻度线 |
12.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的物质是葡萄糖 | |
| B. | 制造新版人民币所用的棉花,优质针叶木等原料的主要成分是纤维素 | |
| C. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,属于物理变化 |
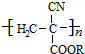 从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下: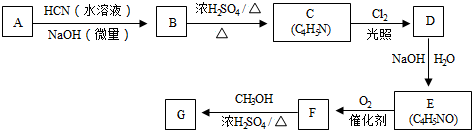
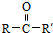 $→_{NaOH(微量)}^{HCN(水溶液)}$
$→_{NaOH(微量)}^{HCN(水溶液)}$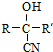
 .其核磁共振氢谱显示为2组峰,峰面积比为1:6.
.其核磁共振氢谱显示为2组峰,峰面积比为1:6. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl.
+NaCl.