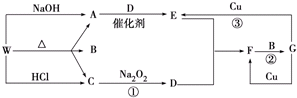
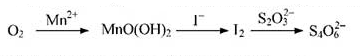题目内容
14.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 12.2 | 3.2 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
(1)硝酸的浓度为多大?
(2)每份金属的质量为多少?
(3)编号④中最多产生的气体积V为多少升?(该问答案取整数)
分析 由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为12.2g-3.2g=9g,
生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,
根据电子转移守恒可知,参加反应金属的物质的量为$\frac{0.1mol×(5-2)}{2}$=0.15mol,
参加反应金属的平均摩尔质量为$\frac{9.0g}{0.15mol}$=60g/mol,
故该过程既有Fe参加反应,又有铜参与反应,但反应后铁和铜均变为+2价.
根据NO的体积结合方程式计算硝酸的物质的量,
根据c=$\frac{n}{V}$计算硝酸的物质的量浓度;
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为3.2g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,
由于在①中铁已反应完,故该过程金属只有Cu参加反应,根据电子转移守恒,
则Cu的物质的量=$\frac{0.1mol×(5-2)}{2}$=0.15mol,Cu的质量=0.15mol×64g/mol=9.6g,大于参加反应金属的质量,故该过程除了Cu反应,还有生成的Fe2+反应.据此分析.
解答 解:(1)由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为12.2g-3.2g=9g,
生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,
根据电子转移守恒可知,参加反应金属的物质的量为$\frac{0.1mol×(5-2)}{2}$=0.15mol,
参加反应金属的平均摩尔质量为$\frac{9.0g}{0.15mol}$=60g/mol,
故该过程既有Fe参加反应,又有铜参与反应,但反应后铁和铜均变为+2价.
故在100mL硝酸溶液中,做酸的硝酸的物质的量为n=0.15mol×2=0.3mol,而做氧化剂被还原的硝酸的物质的量为0.1mol,故在100mL硝酸溶液中,含有的硝酸的物质的量为0.4mol,则物质的量浓度c=$\frac{n}{V}$=$\frac{0.4mol}{0.1L}$=4mol/L.
答:硝酸的浓度为4mol/L;
(2)由于当加入200mL硝酸溶液时,参加反应的有铁和铜,故和前100mL硝酸反应的只有铁,且反应后变为+2价,而生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应铁的物质的量为$\frac{0.1mol×(5-2)}{2}$=0.15mol,质量m=0.15mol×56g/mol=8.4g,故每份金属的质量为8.4g+12.2g=20.6g,答:每份金属的质量为20.6g;
(3)设20.6g混合物中含铁的物质的量为xmol,含铜的物质的量为ymol,根据质量有:56x+64y=20.6①
然后根据在加入200mL硝酸即0.8mol硝酸时,剩余的3.2g为铜,放出了0.2molNO气体,此时溶液中铁和铜元素均为+2价,故根据硝酸的守恒可知:2x+2(y-$\frac{3.2g}{64g/mol}$)+0.2=0.4L×4mol/L②
解①②可得:x=0.225mol
y=0.125mol.
由于在硝酸为300mL时,溶液中的Fe2+即开始被氧化为Fe2+.当Fe2+完全被氧化为Fe3+时,做酸的硝酸的物质的量为n=0.225mol×3+0.125mol×2=0.925mol,而根据得失电子数守恒可知,生成的NO的物质的量n=$\frac{0.225mol×3+0.125mol×2}{3}$=0.308mol,故共需硝酸的物质的量n=0.925mol+0.308mol=1.233mol,小于400mL硝酸溶液中的硝酸的物质的量1.6mol,故当加入400mL硝酸时,Fe2+完全被氧化为Fe3+,生成NO的物质的量为0.308mol,则在标况下的体积为6906mL.
答:生成气体的最大体积为6906mL.
点评 本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是关键,侧重对学生综合能力的考查,过程复杂、计算量较大,为易错题目,难度较大.

| A. | 煤的气化是物理变化 | |
| B. | 蛋白质的基本结构单元是氨基酸 | |
| C. | 在蛋白质溶液中加入CuSO4溶液,可使蛋白质的溶解度降低而析出 | |
| D. | 乙醛、葡萄糖、淀粉都能与新制的银氨溶液发生反应 |
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 | |
| C. | 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管加蒸馏水至刻度线 |
| A. | SO2具有氧化性,可用于漂白纸浆 | B. | NH4HCO3受热易分解,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | D. | Al2O3熔点高,可用作耐高温材料 |
| A. | 离子结构示意图: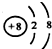 可以表示16O2-,也可以表示18O2- 可以表示16O2-,也可以表示18O2- | |
| B. | 比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| C. | 氯化铵的电子式为: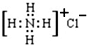 | |
| D. | 二氧化碳分子的比例模型是: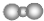 |
| A. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的物质是葡萄糖 | |
| B. | 制造新版人民币所用的棉花,优质针叶木等原料的主要成分是纤维素 | |
| C. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,属于物理变化 |
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A. | Y、Z、W处于周期表中同一周期 | B. | 通常状况下得不到纯净的YZ2 | ||
| C. | X与Z形成的化合物不含非极性键 | D. | X、Z、W形成的化合物为弱酸 |