题目内容
18.乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如图A、B、C.已知0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜悬浊液一起加热,会产生红色沉淀.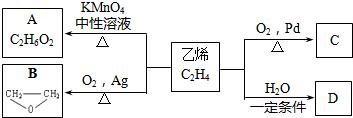
完成下列填空:
(1)工业上用石油得到乙烯的方法是C.
A.分馏 B.干馏 C.裂解D.裂化
(2)A中官能团的名称为羟基;写出D的同分异构体CH3OCH3.
(3)乙烯到D的化学方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型是加成反应.
(4)写出A与足量乙酸反应的化学方程式
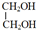 +2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
分析 0.01molA与足量的金属钠完全作用后,生成224mL(标准状况)气体,即生成氢气为$\frac{0.224L}{22.4L/mol}$=0.01mol,结合A的分子式可知,A分子中含有2个羟基,故A为乙二醇,结构简式为 .C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀,则C含有醛基,故C为CH3CHO.乙烯与水发生加成反应生成D为CH3CH2OH,以此解答该题.
.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀,则C含有醛基,故C为CH3CHO.乙烯与水发生加成反应生成D为CH3CH2OH,以此解答该题.
解答 解:(1)工业上通过石油裂解得到乙烯,故答案为:C;
(2)A结构简式为 ,官能团的名称为羟基,D为CH3CH2OH,对应的同分异构体为CH3OCH3,故答案为:羟基;CH3OCH3;
,官能团的名称为羟基,D为CH3CH2OH,对应的同分异构体为CH3OCH3,故答案为:羟基;CH3OCH3;
(3)乙烯到D的化学方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,属于加成反应,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;加成反应;
(4)A为 ,与足量乙酸发生酯化反应,方程式为
,与足量乙酸发生酯化反应,方程式为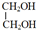 +2CH3COOH $→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O,
+2CH3COOH $→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O,
故答案为: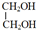 +2CH3COOH $→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
+2CH3COOH $→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
点评 本题考查有机物推断,为高考常见题型和高频考点,侧重考查学生的分析能力,题目涉及烯烃、醇、醛的性质与转化,计算确定A为乙二醇是关键,难度不大.

练习册系列答案
相关题目
7.下列溶液一定呈中性的是( )
| A. | c(H+)=c(OH-) | B. | pH=7 | C. | KW=10-14 | D. | c(H+)=10-7mol/L |
6.下列化合物的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
13.下列实验过程中,始终无明显现象的是( )
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | 乙烯通入溴的CCl4溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
3.下列说法正确的是( )
| A. | 铅蓄电池充电时,阳极固体质量增大 | |
| B. | 0.1mol•L-1CH3COONa溶液加热后,溶液的pH减小 | |
| C. | 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1氨水c(H+).c(NH3•H2O)减小 |
10.表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 盛放氢氧化钠溶液的试剂瓶用橡胶塞 | 氢氧化钠可以与玻璃中的二氧化硅反应生成粘性的硅酸钠 | Ⅰ对,Ⅱ错,无 |
| B | 氯水可以使有色布条褪色 | 氯气具有漂白性 | Ⅰ错,Ⅱ对,有 |
| C | 二氧化硅可以与水反应生成硅酸 | 二氧化硅是酸性氧化物具有酸性氧化物的通性 | Ⅰ对,Ⅱ对,无 |
| D | 为增强漂白能力使用漂白粉时向漂白粉溶液中加入少量白醋 | 醋酸的酸性比次氯酸强 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,56g由N2和CO组成的混合气体含有的原子数目为4 NA | |
| B. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数为0.3NA | |
| C. | 1 L 1.0mol•L-1的NaAlO2水溶液中含有的总原子数为2NA | |
| D. | 1 mol羟基中含有的电子数为10NA |
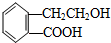 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.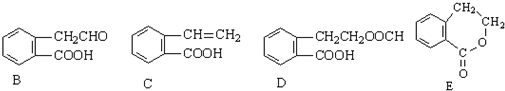
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.