题目内容
7.下列溶液一定呈中性的是( )| A. | c(H+)=c(OH-) | B. | pH=7 | C. | KW=10-14 | D. | c(H+)=10-7mol/L |
分析 根据c(H+)、c(OH-)的相对大小判断溶液的酸碱性,以此来解答.
解答 解:A.c(H+)=c(OH-)时,溶液一定为中性,故A选;
B.温度未知,pH=7的溶液不一定为中性,如100℃pH=6为中性,故B不选;
C.25℃时酸、碱、盐溶液中Kw=10-14,不一定为中性,故C不选;
D.温度未知,不能判断c(H+)=10-7mol/L时溶液的酸碱性,故D不选;
故选A.
点评 本题考查溶液酸碱性的判断,为高频考点,把握酸碱性的判断方法为解答的关键,侧重分析与应用能力的考查,注意温度与Kw、pH的关系,题目难度不大.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
17.NA为阿伏加德罗常数的值.下列说法正确是( )
| A. | 44g CO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5mol CH5+中含有的电子数目为5NA | |
| D. | 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol-CH3中含有的质子数为10NA | |
| B. | 25℃时,1 L pH=ll的氨水中OH-的数目为0.001NA | |
| C. | 1 mol苯乙烯(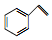 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| D. | 合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6 NA |
2.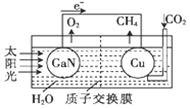 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液 |
12.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y元素的最外层电子数是其次外层电子数的三倍,Z元素是光导纤维的组成元素之一,W与Z同主族,R与Y的原子核外电子数之比为2:1,下列叙述错误的是( )
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | 原子半径大小关系为:X>R>Z>Y>W | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
19.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X分别与Y、Z形成10电子的化合物P和Q.P能使湿润的红色石蕊试纸变蓝,Q常温下是一种液体.下列说法正确的是( )
| A. | 简单离子半径大小关系为W>Z | |
| B. | P形成的水溶液能导电,说明P属于电解质 | |
| C. | 电解W的氯化物水溶液可以得到W单质 | |
| D. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 |
16.下列离子方程式书写不正确的是( )
| A. | AlCl3 溶液与烧碱溶液反应,当 n(OH-):n(Al3+)=7:2 时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2 溶液与 NaHS 溶液反应,当 n(CuCl2):n(NaHS)=1:2 时 Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2 与 FeBr2 溶液反应,当 n(Cl2):n(FeBr2)=1:1 时,2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6Cl- | |
| D. | Fe 与稀硝酸反应,当 n(Fe):n(HNO3)=1:2 时,3 Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
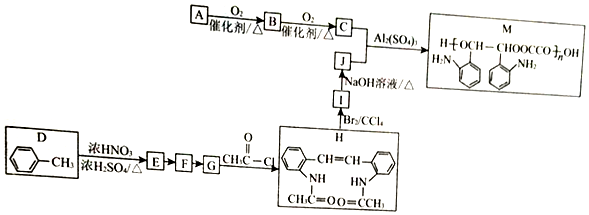
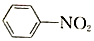 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$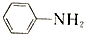 (-NH3容易被氧化)
(-NH3容易被氧化)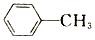 $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$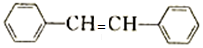
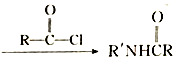 (R和R′代表烃基)
(R和R′代表烃基)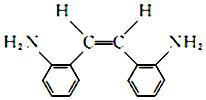 .
.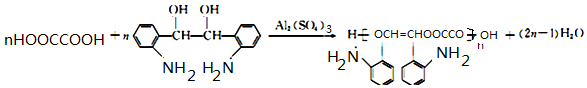 .
. 的合成路线
的合成路线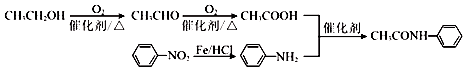 .
.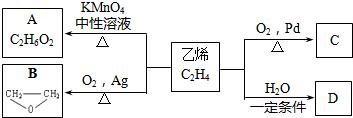
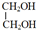 +2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.