题目内容
3.室温下,向下列溶液中加人某种物质至溶液呈中性(忽略加入的物质对溶液体积的影响),溶液中部分微粒的物质的量浓度关系错误的是( )| A. | 向稀盐酸中滴加浓氨水:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 向NH4HSO4溶液中加入NaOH固体:c(Na+)>c(SO42-)>c(NH4+) | |
| C. | 向CH3COONa溶液中通入HCl气体:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 向KOH溶液中通入SO2气体:c(K+)=2c(SO32-)+c(HSO3-) |
分析 A.pH=7,则c(H+)=c(OH-),结合电荷守恒分析;
B.假若NH4HSO4与NaOH按照1:1反应,此时溶液中铵根离子为参与反应,氢氧根离子与氢离子恰好反应完全,氨根离子要部分水解,故c(Na+)=c(SO42-)>c(NH4+),此时溶液呈酸性,现在呈中性,还得再加入一些氢氧化钠,故c(Na+)>c(SO42-)>c(NH4+);
C.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,反应后溶液中溶质为NaCl、醋酸和醋酸钠;
D.根据电荷守恒判断.
解答 解:A.pH=7,则c(H+)=c(OH-),结合电荷守恒可知,c(H+)+c(NH4+)=c(OH-)+c(Cl-),c(Cl-)=c(NH4+),故A错误;
B.假若NH4HSO4与NaOH按照1:1反应,此时溶液中铵根离子为参与反应,氢氧根离子与氢离子恰好反应完全,氨根离子要部分水解,故c(Na+)=c(SO42-)>c(NH4+),此时溶液呈酸性,现在呈中性,还得再加入一些氢氧化钠,故c(Na+)>c(SO42-)>c(NH4+),故B正确;
C.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,c(H+)=c(OH-),HCl不足,反应后溶液中溶质为NaCl、醋酸和醋酸钠,由电荷守恒可知,c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知,c(Na+)=c(CH3COOH)+c(CH3COO-),则c(Na+)>c(CH3COOH)=c(Cl-),故C正确;
D.根据电荷守恒知,c(K+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),至溶液pH=7,c(H+)=c(OH-),则c(K+)=2c(SO32-)+c(HSO3-),故D正确.
故选A.
点评 本题考查离子浓度大小比较,把握发生的反应、盐类水解及电离为解答的关键,注意pH=7的信息及应用,题目难度不大.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案| 选项 | U | W | Y | X | 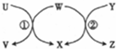 |
| A | Fe | H20 | C | H2 | |
| B | Na | H2O | Na2O2 | NaOH | |
| C | HBr | Cl2 | CH4 | HCl | |
| D | Fe3O4 | Al | NaOH | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物的水化物的碱性:A<C | |
| B. | B、D形成的化合物的溶于水形成B2D3溶液 | |
| C. | A、E形成的化合物只含离子键和极性键 | |
| D. | E的单质可以从D的氢化物中置换出D单质 |
| A. | 离子半径大小顺序为:Z>X>Y>W | |
| B. | W、X、Y三种元素都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | X、Y、Z三种元素与W 元素形成的最简单化合物的沸点依次升高 | |
| D. | X、Y、Z三种元素形成的化合物的水溶液一定显中性 |
| A. | Si | B. | P | C. | S | D. | Cl |
| A. | 13 | B. | 4个 | C. | 6个 | D. | 7个 |
| 实验现象 |  | |||
| A | 白色沉淀 | 臭鸡蛋气味气体 | 无色溶液 | 无色溶液 |
| B | 无色溶液 | 无色无味气体 | 白色沉淀 | 白色沉淀 |
| C | 无色溶液 | 浅黄色沉淀 | 白色沉淀 | 白色沉淀 |
| D | 白色沉淀 | 浅黄色沉淀 | 无色溶液 | 无色溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | HClO4 H2SO4 H3PO4 H4SiO4 | B. | H2SO4 H2SO3 HNO3 HNO2 | ||
| C. | HClO4 HClO3 HClO2 HClO | D. | HClO4 H2SO4 H2SO3 H2CO3 |
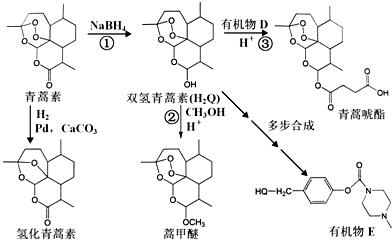
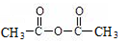 +H-OH→2
+H-OH→2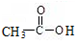
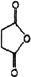 .
.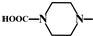 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式 或
或 或
或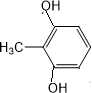 .
.