题目内容
13.下列制质中,酸性由强到弱错误的是( )| A. | HClO4 H2SO4 H3PO4 H4SiO4 | B. | H2SO4 H2SO3 HNO3 HNO2 | ||
| C. | HClO4 HClO3 HClO2 HClO | D. | HClO4 H2SO4 H2SO3 H2CO3 |
分析 非金属性越强,对应最高价含氧酸的酸性越强;同种元素的含氧酸中,非羟基氧原子个数越多,酸性越强,以此来解答.
解答 解:A.非金属性Cl>S>P>Si,最高价含氧酸的酸性HClO4 H2SO4 H3PO4 H4SiO4为由强到弱,故A正确;
B.硫酸、硝酸为强酸,H2SO3 、HNO2为弱酸,酸性不能由强到弱,故B错误;
C.同种元素的含氧酸中,非羟基氧原子个数越多,酸性越强,则HClO4 HClO3 HClO2 HClO的酸性由强到弱,故C正确;
D.非金属性Cl>S,且硫酸为强酸,亚硫酸为弱酸,二氧化硫与碳酸氢钠溶液反应生成碳酸可知,HClO4 H2SO4 H2SO3 H2CO3 的酸性由强到弱,故D正确;
故选B.
点评 本题考查非金属性及酸性的比较,为高频考点,把握元素的性质、酸性比较方法等为解答的关键,侧重分析、应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
3.室温下,向下列溶液中加人某种物质至溶液呈中性(忽略加入的物质对溶液体积的影响),溶液中部分微粒的物质的量浓度关系错误的是( )
| A. | 向稀盐酸中滴加浓氨水:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 向NH4HSO4溶液中加入NaOH固体:c(Na+)>c(SO42-)>c(NH4+) | |
| C. | 向CH3COONa溶液中通入HCl气体:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 向KOH溶液中通入SO2气体:c(K+)=2c(SO32-)+c(HSO3-) |
1.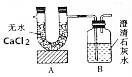 已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置).
已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置).
已知:2个-OH连接在同一个碳原子上不稳定,会迅速发生如下变化:
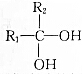 →
→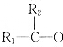 +H2O
+H2O
根据实验数据回答下列问题.
(1)该燃料的分子式为C5H12O2.
(2)1mol该燃料与金属钠反应生成1molH2,则该燃料的分子结构种含有的官能团名称为羟基,若分子结构中有3个甲基,则燃料的结构简式为CH3CH(OH)COH(CH3)2.
(3)该燃料的一种同系物只有2个碳原子,写出该同系物与足量醋酸反应的化学方程式:CH2OHCH2OH+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
 已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置).
已知某燃料含有碳、氢、氧三种元素.为了测定该燃料的结构,现将1.04g燃料放人足量的氧气中充分燃烧,经测定消耗氧气1.568L(已转换为标准状况),并使产生的气体全部通人如图所示的装置,得到如表所示的实验数据(假设产生的气体被完全吸收,且没有空气进人该装置). | 实验前 | 实验后 | |
| A装置的质量 | 101.1g | 102.18g |
| B装置的质量 | 312.0g | 314.2g |
 →
→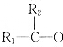 +H2O
+H2O根据实验数据回答下列问题.
(1)该燃料的分子式为C5H12O2.
(2)1mol该燃料与金属钠反应生成1molH2,则该燃料的分子结构种含有的官能团名称为羟基,若分子结构中有3个甲基,则燃料的结构简式为CH3CH(OH)COH(CH3)2.
(3)该燃料的一种同系物只有2个碳原子,写出该同系物与足量醋酸反应的化学方程式:CH2OHCH2OH+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
18.硼的最高价含氧酸的化学式不可能是( )
| A. | HBO2 | B. | H2BO3 | C. | H3BO3 | D. | H2B4O7 |
5.类比推理是化学中常用的思维方法.下列推理正确的是( )
| A. | CO2是直线型分子,推测CS2也是直线型分子 | |
| B. | SiH4的沸点高于CH4,推测H2Se的沸点高于H2S | |
| C. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
16.目前,我国城市供水处理技术由混凝、沉淀、过滤和消毒等过程组成.下列说法中不正确的是( )
| A. | 传统的无机混凝剂按金属盐可分为铝盐系和铁盐系两大类 | |
| B. | NCl3可用于水消毒的原因是NCl3跟水反应生成了NH3 | |
| C. | 用ClO2代替Cl2作消毒剂可减小水中有害氯代有机物的浓度 | |
| D. | 新型水处理剂高铁酸钠(Na2FeO4)既是消毒剂又是混凝剂 |
17.某烃分子中结构含一个苯环、两个碳碳双键和一个碳碳三键,它的分子式可能为( )
| A. | C9H12 | B. | C17H20 | C. | C20H30 | D. | C12H20 |