题目内容
12.2A(g)?B(g)△H1(△H1<0);2A(g)?B(l)△H2;下列能量变化示意图正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 △H<0的反应为放热反应,反应物的总能量大于生成物的总能量,同种物质,气态时能量大于液态时的能量,由此分析解答.
解答 解:(1)已2A(g)?B(g)△H1(△H1<0);2A(g)?B(l)△H2;
△H<0的反应为放热反应,反应物的总能量大于生成物的总能量,则2A(g)的总能量大于B(g)的总能量,B(g)的总能量大于B(l)的总能量,所以B图象符合;
故选:B.
点评 本题考查化学反应中能量变化图,放热反应是反应物的总能量大于生成物的总能量,气态时能量大于液态时的能量,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
3.用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 0.1mol/L稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移电子数为2 NA | |
| D. | 标准情况下,22.4LCl2和HCl的混合气体中含分子总数为NA |
20.下列表示正确的是( )
| A. | CO2的电子式: | B. | 乙炔的结构式:CH≡CH | ||
| C. | CH4的球棍模型: | D. | Cl-离子的结构示意图: |
7.W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( )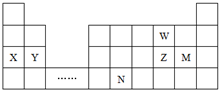

| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
17.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(保准状况).
下列说法正确的是( )
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(保准状况).
下列说法正确的是( )
| A. | 该固体中一定含有NH4+、CO32-、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl-、Na+ | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
4.下列说法不正确的是( )
| A. | 实验室里易燃试剂与强氧化性试剂应分开放置并远离火源 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 滴定实验中所用到的滴定管和移液管,在使用前均需干燥或用相应的溶液润洗,容量瓶、锥形瓶则不应润洗 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
1.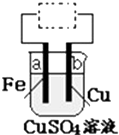 用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
 用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )| A. | 构成原电池时b极反应为:Cu-2e-═Cu2+ | |
| B. | 构成的原电池或电解池工作后就可能产生大量气体 | |
| C. | 构成电解池时b 极质量既可能减少也可能增加 | |
| D. | 构成电解池时a极质量一定会减少 |
2.化学与生产、生活、社会密切相关.下列说法中正确的是( )
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 不锈钢具有较强的耐腐蚀性,纯铁也有较强的耐腐蚀性 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 | |
| D. | 对石油进行分馏可以得到许多苯的同系物 |
