题目内容
3.用NA表示阿伏伽德罗常数,下列叙述中正确的是( )| A. | 0.1mol/L稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移电子数为2 NA | |
| D. | 标准情况下,22.4LCl2和HCl的混合气体中含分子总数为NA |
分析 A、求出硫酸的物质的量,然后根据1mol硫酸能电离出1mol硫酸根来分析;
B、铝离子是弱碱阳离子,在溶液中会水解;
C、求出镁的物质的量,然后根据1mol镁失去2mol电子来分析;
D、求出混合气体的物质的量,然后根据分子数N=nNA来分析.
解答 解:A、硫酸的物质的量n=CV=0.1mol/L×0.1L=0.01mol,而1mol硫酸能电离出1mol硫酸根,故0.01mol硫酸溶液中含0.01NA个硫酸根,故A错误;
B、铝离子是弱碱阳离子,在溶液中会水解,故溶液中铝离子、硫酸根的总数小于NA个,故B错误;
C、2.4g镁的物质的量为0.1mol,而1mol镁失去2mol电子,故0.1mol镁失去0.2NA个电子,故C错误;
D、标况下22.4L混合气体的物质的量为1mol,而分子数N=nNA=NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
17.下列说法中错误的是( )
| A. | 0.3 mol H2SO4 | B. | 1 mol H2O | C. | 0.5 mol 硫 | D. | 3 mol 氢原子 |
14.恒温恒压下,在一个可变容积的容器中发生如下反应:
H2(g)+Br2(g)?2HBr(g)已知加入1molH2和2molBr2时,达到平衡后,生成a molHBr,(见下表“已知项”).在相同的条件下,改变起始加入情况,填写表中空白:
H2(g)+Br2(g)?2HBr(g)已知加入1molH2和2molBr2时,达到平衡后,生成a molHBr,(见下表“已知项”).在相同的条件下,改变起始加入情况,填写表中空白:
| 编号 | 起始状态 | 平衡时HBr物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| (1) | 2 | 4 | 0 | 2a |
| (2) | 0 | 0.5 | 1 | 0.5a |
8.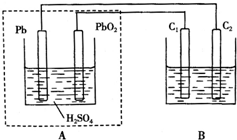 用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
 用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )| A. | 铅蓄电池工作一段时间后A溶液的pH变小 | |
| B. | 当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol | |
| C. | 当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过 | |
| D. | 铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4═PbSO4+2H2O+SO${\;}_{4}^{2-}$ |
15.仪器名称为“烧瓶”的是( )
| A. | 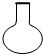 | B. | 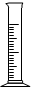 | C. | 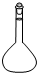 | D. |  |

 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.