题目内容
20.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g);△H>0.反应过程中SO2、O2、SO3物质的量的变化如图所示,下列说法中不正确的是( )
| A. | .反应从0min开始,到第一次平衡时,二氧化硫的转化率为40% | |
| B. | 反应进行到10min至15min时,曲线发生变化可能是因为升高了温度 | |
| C. | 反应进行至20min时,曲线发生变化是因为通入了氧气 | |
| D. | 在15min~20min、25min~30min内时反应处于平衡状态 |
分析 A.根据图象判断第一次达到平衡时消耗二氧化硫的物质的量,再计算出其转化率;
B.由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变;
C.由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大;
D.反应速率v=$\frac{△c}{△t}$,在10-15min和20-25min的时间变化相同,物质浓度不变说明反应达到平衡.
解答 解:A.根据图象曲线变化可知,第一次达到平衡时二氧化硫的物质的量为0.16mol,则二氧化硫的转化率为$\frac{0.2-0.16}{0.2}$×100%=20%,故A错误;
B.由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,且平衡仍向正反应方向移动,可为缩小容器体积,增大压强,也可是加入催化剂,反应速率增大,因反应还没有达到平衡,也可能为升高温度,故B正确;
C.由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大氧气的浓度,故C正确;
D.在10-15min和20-25min的时间变化都为5min,三氧化硫、氧气和二氧化硫物质的量保持不变,反应达到平衡状态,故D正确;
故选A.
点评 本题考查了化学平衡的计算,涉及化学反应速率、化学平衡的影响因素等知识,题目难度中等,计算量较大,知识点较多,注意掌握化学平衡及其影响,试题充分考查的学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
10.从理论上分析,关于Fe-CuSO4溶液-Cu原电池的叙述正确的是( )
| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
11.工业上用异丙苯氧化法合成苯酚,其生产流程如下图:
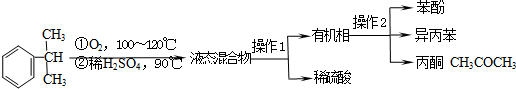
有关物质的性质如表:
(1)“操作2”的名称是分馏或蒸馏.
(2)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验.
(3)为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水稀释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀后加入1gKI固体(足量),再摇匀,放置5min.用0.01000mol/LNa2S2O3标准溶液滴定至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去,用去Na2S2O3标准溶液14.46mL;同时以水代替污水试样做对比实验,用去Na2S2O3标准溶液38.46mL.已知上述实验中发生的反应有:KBrO3+5KBr+6HCl=3Br2+3H2O+6KCl 2Na2S2O3+I2=Na2S4O6+2NaI,则此污水中苯酚的含量376.0mg/L.(以mg/L表示,苯酚的相对分子质量为94)

有关物质的性质如表:
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精. | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水 和酒精等有机溶剂. | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
(2)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验.
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机 杂质的试剂是①A.(填写右边字母) | A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯 酚的方案: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液,若试管中溶液颜色变为②紫色,则丙酮中含有苯酚,反之则没有. |
8.下列有关物质的量的说法中,正确的是( )
| A. | Fe的摩尔质量为56g | |
| B. | 常温常压下,71gCl2含有NA个Cl2分子 | |
| C. | 1mol O2在常温下的体积都为22.4L | |
| D. | 将1molNaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol•L-1 |
5.取四等份铝,分别加入足量的下列溶液中,充分反应后,放出氢气最多的是( )
| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |
9.在一个温度恒定且容积保持不变的容器中进行着如下反应:H2(g)+I2(g)?2HI(g),能说明该反应已达到平衡状态的是( )
| A. | 容器内${C_{({H_2})}}={C_{({I_2})}}={C_{(HI)}}$ | B. | 容器内的压强不再变化 | ||
| C. | 断裂1mol H-H的同时生成2mol H-I | D. | 容器内颜色不再变化 |
10.用NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为2NA | |
| C. | 常温常压下,15g乙烷分子数目为 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
 (1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.