题目内容
12. (1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.(2)如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
答下列问题:
①写出氢氧燃料电池工作时正极电极反应方程式:O2+2H2O+4e-=4OH-.
②如果该氢氧燃料电池每转移1mol电子,消耗标准状况下氧气的体积为5.6L.
③阳离子向正极移动(填写正或负),反应一段时间后整个溶液的碱性减弱(填增强,减弱或者不变).
④若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为CH4+10OH--8e=CO32-+7H2O.
分析 (1)铜、银与硝酸银设计的原电池,负极为铜,被氧化发生氧化反应;
(2)①燃料电池中电子从负极流向正极,正极上氧气得电子和水生成氢氧根离子;
②根据电极方程式中电子与氧气的关系求算;
③原电池中阳离子移向正极,根据总反应判断溶液酸碱性的变化;
④甲烷燃料电池中甲烷在负极失电子生成碳酸根离子和水,先写出负极反应式,然后写出相应的电极反应式.
解答 解:(1)铜、银与硝酸银设计的原电池,负极为铜,被氧化发生氧化反应,电极方程式为:Cu-2e-═Cu2+,故答案为:铜;Cu-2e-═Cu2+;
(2)①氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:2H2O+O2+4e-═4OH-;
故答案为:2H2O+O2+4e-═4OH-;
②已知2H2O+O2+4e-═4OH-,则每转移1mol电子消耗的氧气为:$\frac{1}{4}$×1mol=0.25mol,所以V(O2)=nVm=0.25mol×22.4L/mol=5.6L;
故答案为:5.6L;
③原电池中阳离子移向正极;燃料电池的总反应为2H2+O2=2H2O,反应后溶液体积增大,溶液的碱性减弱;
故答案为:正;减弱;
④燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为CH4+10OH--8e-═CO32-+7H2O,故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查了燃料电池电极反应式及电池反应方程式的书写,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,书写电极反应式时要结合电解质溶液确定生成的离子.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
3.下列有关能源的说法错误的是( )
| A. | 风能是人类通过风车等工具获取的能源,但属于一次能源 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 月球土壤中含有丰富的质量数为3的氦,它可作为未来核能的重要原料 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
20.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g);△H>0.反应过程中SO2、O2、SO3物质的量的变化如图所示,下列说法中不正确的是( )

| A. | .反应从0min开始,到第一次平衡时,二氧化硫的转化率为40% | |
| B. | 反应进行到10min至15min时,曲线发生变化可能是因为升高了温度 | |
| C. | 反应进行至20min时,曲线发生变化是因为通入了氧气 | |
| D. | 在15min~20min、25min~30min内时反应处于平衡状态 |
4.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )


| A. | 化学反应中能量变化的主要原因是物质状态的改变 | |
| B. | 铝热反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为吸热反应 |
1.关于元素周期表的说法正确的是( )
| A. | 元素周期表有10个主族 | B. | ⅠA族的元素都是金属元素 | ||
| C. | 元素周期表有7个周期 | D. | 短周期是指第一、二周期 |
2.用过量的锌与稀硫酸反应制H2时,下列能减缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量Na2CO3固体 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量NaOH固体 | D. | 加水 |
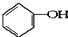 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$