题目内容
10.用NA表示阿伏加德罗常数.下列说法正确的是( )| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为2NA | |
| C. | 常温常压下,15g乙烷分子数目为 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
分析 A、标况下苯为液态;
B、氦气为单原子分子;
C、分子数N=$\frac{m}{M}{N}_{A}$;
D、溶液体积不明确.
解答 解:A、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、氦气为单原子分子,故1mol氦气中含有的核外电子数为2NA个,故B正确;
C、分子数N=$\frac{m}{M}{N}_{A}$=$\frac{15g}{30g/mol}$×NA=0.5NA个,故C错误;
D、溶液体积不明确,故溶液中含有的氢离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g);△H>0.反应过程中SO2、O2、SO3物质的量的变化如图所示,下列说法中不正确的是( )

| A. | .反应从0min开始,到第一次平衡时,二氧化硫的转化率为40% | |
| B. | 反应进行到10min至15min时,曲线发生变化可能是因为升高了温度 | |
| C. | 反应进行至20min时,曲线发生变化是因为通入了氧气 | |
| D. | 在15min~20min、25min~30min内时反应处于平衡状态 |
1.关于元素周期表的说法正确的是( )
| A. | 元素周期表有10个主族 | B. | ⅠA族的元素都是金属元素 | ||
| C. | 元素周期表有7个周期 | D. | 短周期是指第一、二周期 |
18.用锌片与1mol•L-1稀盐酸反应制取氢气,下列措施不能使反应速率增大的是( )
| A. | 适当加热 | B. | 改用锌粉 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量1mol•L-1稀硫酸 |
5.氢能开发的首要问题是研究如何以水为原料获取氢气,下列研究方向可行的是( )
| A. | 电解水产生氢气 | |
| B. | 开发特殊物质作催化剂,降低水分解过程中所需要的能量 | |
| C. | 大量建设水电站,用电力分解水制取氢气 | |
| D. | 寻找更多化石燃料,利用燃烧放热,使水分解产生氢气 |
15.今年入春以来,韩店雾霾天气频繁出现,空气质量很差,严重影响老百姓的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM25的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
2.用过量的锌与稀硫酸反应制H2时,下列能减缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量Na2CO3固体 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量NaOH固体 | D. | 加水 |
19.下列实验,能达到目的是( )
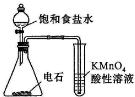

| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |

 $\stackrel{H_{2}O}{→}$RCOOH+R′COOH(其中R,R′是烃基)
$\stackrel{H_{2}O}{→}$RCOOH+R′COOH(其中R,R′是烃基)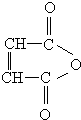 ,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.
,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.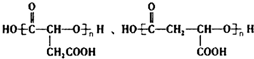 .
.