题目内容
9.在一个温度恒定且容积保持不变的容器中进行着如下反应:H2(g)+I2(g)?2HI(g),能说明该反应已达到平衡状态的是( )| A. | 容器内${C_{({H_2})}}={C_{({I_2})}}={C_{(HI)}}$ | B. | 容器内的压强不再变化 | ||
| C. | 断裂1mol H-H的同时生成2mol H-I | D. | 容器内颜色不再变化 |
分析 可逆反应H2(g)+I2(g)?2HI(g)达到平衡状态时,正逆反应速率相等,反应体系中各组分的浓度、百分含量不再变化,据此进行判断.
解答 解:A.各组分的浓度相等时,正逆反应速率不一定相等,则无法判断是否达到平衡状态,故A错误;
B.该反应是气体体积不变的反应,则反应过程中压强实质不变,无法根据压强变化判断平衡状态,故B错误;
C.断裂1mol H-H的同时生成2mol H-I,表示的都是正反应速率,无法判断正逆反应速率是否相等,故C错误;
D.反应体系中只有碘单质有色,当容器内气体颜色不变时,表明各组分浓度不再变化,说明达到平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.对于反应A2+B2=2AB来说,下列速率表示该反应最快的是( )
| A. | V(B2)=0.2mol/(L•S) | B. | V(A2)=6mol/(L•min) | ||
| C. | V(AB)=8mol/(L•min) | D. | V(B2)=1.2mol/(L•min) |
20.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g);△H>0.反应过程中SO2、O2、SO3物质的量的变化如图所示,下列说法中不正确的是( )

| A. | .反应从0min开始,到第一次平衡时,二氧化硫的转化率为40% | |
| B. | 反应进行到10min至15min时,曲线发生变化可能是因为升高了温度 | |
| C. | 反应进行至20min时,曲线发生变化是因为通入了氧气 | |
| D. | 在15min~20min、25min~30min内时反应处于平衡状态 |
4.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )


| A. | 化学反应中能量变化的主要原因是物质状态的改变 | |
| B. | 铝热反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为吸热反应 |
14.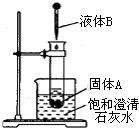 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
(1)试推测试剂A和B各是什么?(写出两组)
(2)解释烧杯中澄清石灰水变浑浊的原因:A与B反应放出热量,使烧杯中澄清的饱和石灰水温度升高,Ca(OH)2的溶解度随温度的升高而降低,因而析出Ca(OH)2沉淀,溶液变浑浊.
 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:(1)试推测试剂A和B各是什么?(写出两组)
| 固体试剂A | 液体试剂B | |
| ① | ||
| ② |
1.关于元素周期表的说法正确的是( )
| A. | 元素周期表有10个主族 | B. | ⅠA族的元素都是金属元素 | ||
| C. | 元素周期表有7个周期 | D. | 短周期是指第一、二周期 |
18.用锌片与1mol•L-1稀盐酸反应制取氢气,下列措施不能使反应速率增大的是( )
| A. | 适当加热 | B. | 改用锌粉 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量1mol•L-1稀硫酸 |
19.下列实验,能达到目的是( )
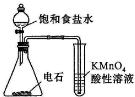

| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |
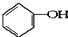 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$