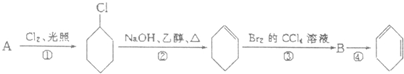
题目内容
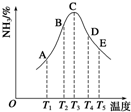 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是
(2)此可逆反应的正反应是
(3)AC段的曲线是增函数,CE段曲线是减函数,试从反应速率和平衡角度说明理由:
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据图象中曲线变化判断是否达到化学平衡状态;
(2)随着温度升高氨气的体积分数减小,据此判断热效应;
(3)因为反应开始时,正反应速率大于逆反应速率,生成NH3的速度比消耗NH3速度要大,故NH3的体积分数[x(NH3)]不断增加,AC段曲线是增函数;而当达到平衡以后,温度升高、平衡逆向移动,故NH3的体积分数[x(NH3)不断减少,CE段曲线是减函数.
(2)随着温度升高氨气的体积分数减小,据此判断热效应;
(3)因为反应开始时,正反应速率大于逆反应速率,生成NH3的速度比消耗NH3速度要大,故NH3的体积分数[x(NH3)]不断增加,AC段曲线是增函数;而当达到平衡以后,温度升高、平衡逆向移动,故NH3的体积分数[x(NH3)不断减少,CE段曲线是减函数.
解答:
解:(1)T3之前氨气体积分数增大,说明化学平衡向正反应方向移动,尚未达到化学平衡状态,T3之后,氨气体积分数减小,化学平衡向逆反应方向移动,A、B未达达到化学平衡状态,故答案为:AB;
(2)氨气的体积分数随着温度升高,而降低,即向逆反应方向移动,说明正反应方向为放热反应,故答案为:放热;
(3)因为反应开始时,正反应速率大于逆反应速率,生成NH3的速度比消耗NH3速度要大,故NH3的体积分数[x(NH3)]不断增加,AC段曲线是增函数;而当达到平衡以后,温度升高、平衡逆向移动,故NH3的体积分数[x(NH3)不断减少,CE段曲线是减函数,
故答案为:AC段:反应开始v正>v逆,反应向右进行生成NH3.CE段:已达平衡,升温使平衡左移,NH3%变小.
(2)氨气的体积分数随着温度升高,而降低,即向逆反应方向移动,说明正反应方向为放热反应,故答案为:放热;
(3)因为反应开始时,正反应速率大于逆反应速率,生成NH3的速度比消耗NH3速度要大,故NH3的体积分数[x(NH3)]不断增加,AC段曲线是增函数;而当达到平衡以后,温度升高、平衡逆向移动,故NH3的体积分数[x(NH3)不断减少,CE段曲线是减函数,
故答案为:AC段:反应开始v正>v逆,反应向右进行生成NH3.CE段:已达平衡,升温使平衡左移,NH3%变小.
点评:本题考查化学平衡图象、影响平衡的因素,难度不大,注意掌握平衡移动原理,根据图象判断温度对平衡移动的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于物质的量、摩尔质量的叙述正确的是( )
| A、0.012 kg 12C中含有约6.02×1023个碳原子 |
| B、1 mol H2O中含有2 mol氢和1 mol氧 |
| C、氢氧化钠的摩尔质量是40 g |
| D、2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4═Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A、一定产生BaSO3沉淀 |
| B、一定产生BaSO4沉淀 |
| C、产生的不全是BaSO4沉淀 |
| D、一定有SO3逸出 |
下列有机物中不溶于水且比水轻的是( )
| A、CCl4 |
| B、乙酸 |
| C、苯 |
| D、溴苯 |
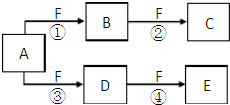 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.