题目内容
根据反应路线及所给信息填空.
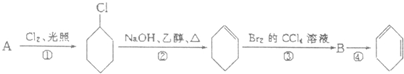
(1)A的结构简式是 ,名称是 .
(2)①的反应类型是 ,③的反应类型是 .
(3)反应③的化学方程式是 .反应④的化学方程式是 .

(1)A的结构简式是
(2)①的反应类型是
(3)反应③的化学方程式是
考点:有机物的合成
专题:有机物的化学性质及推断
分析:由反应①可知A发生取代反应,应为环己烷,结构简式为 ,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷
,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷 ,
, 发生消去反应可生成
发生消去反应可生成 ,以此解答该题.
,以此解答该题.
 ,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷
,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷 ,
, 发生消去反应可生成
发生消去反应可生成 ,以此解答该题.
,以此解答该题.解答:
解:由反应①可知A发生取代反应,应为环己烷,结构简式为 ,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷
,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷 ,
, 发生消去反应可生成
发生消去反应可生成 ,
,
(1)由以上分析可知A为环己烷,结构简式为 ,故答案为:
,故答案为: ;环己烷;
;环己烷;
(2)反应①为环己烷的取代反应,反应③为 与溴的加成反应,故答案为:取代反应;加成反应;
与溴的加成反应,故答案为:取代反应;加成反应;
(3)反应③为 与溴的加成反应,反应的方程式为
与溴的加成反应,反应的方程式为 +Br2→
+Br2→ ,
,
反应④为 的消去反应,反应的方程式为
的消去反应,反应的方程式为 +2 NaOH
+2 NaOH
 +2 NaBr+2 H2O,
+2 NaBr+2 H2O,
故答案为: +Br2→
+Br2→ ;
; +2 NaOH
+2 NaOH
 +2 NaBr+2 H2O.
+2 NaBr+2 H2O.
 ,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷
,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷 ,
, 发生消去反应可生成
发生消去反应可生成 ,
,(1)由以上分析可知A为环己烷,结构简式为
 ,故答案为:
,故答案为: ;环己烷;
;环己烷;(2)反应①为环己烷的取代反应,反应③为
 与溴的加成反应,故答案为:取代反应;加成反应;
与溴的加成反应,故答案为:取代反应;加成反应;(3)反应③为
 与溴的加成反应,反应的方程式为
与溴的加成反应,反应的方程式为 +Br2→
+Br2→ ,
,反应④为
 的消去反应,反应的方程式为
的消去反应,反应的方程式为 +2 NaOH
+2 NaOH| 乙醇 |
| △ |
 +2 NaBr+2 H2O,
+2 NaBr+2 H2O,故答案为:
 +Br2→
+Br2→ ;
; +2 NaOH
+2 NaOH| 乙醇 |
| △ |
 +2 NaBr+2 H2O.
+2 NaBr+2 H2O.
点评:本题考查有机物的合成,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质以及反应的特点,为解答该题的关键,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
下列实验操作正确的是( )
| A、在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 |
| B、实验室制乙烯时,迅速升温到140℃ |
| C、用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸 |
| D、用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 |
在水溶液中能量共存的一组离子是( )
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
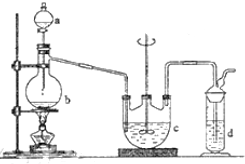 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
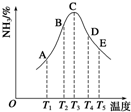 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图: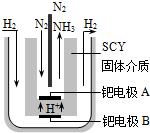 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.