题目内容
已知:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol.
(1)0.1mol Ba(OH)2配成稀溶液,跟足量的稀硝酸反应,能放出 kJ热量;
(2)用10.0L 0.10mol/L CH3COOH溶液与20.0L 0.10mol/L NaOH溶液反应,放出的热量 (选填“大于”、“小于”或“等于”)57.3kJ,理由是 ;
(3)用2L 0.5moL/L的H2SO4与1L 1mol/L的NaOH溶液反应,放出的热量 (选填“大于”、“小于”或“等于”)57.3kJ,理由是 .
(1)0.1mol Ba(OH)2配成稀溶液,跟足量的稀硝酸反应,能放出
(2)用10.0L 0.10mol/L CH3COOH溶液与20.0L 0.10mol/L NaOH溶液反应,放出的热量
(3)用2L 0.5moL/L的H2SO4与1L 1mol/L的NaOH溶液反应,放出的热量
考点:反应热和焓变
专题:化学反应中的能量变化
分析:本题考查中和热,注意中和热是指强酸与强碱的稀溶液完全中和生成1mol水时放出的热量,据此分析.
解答:
解:已知:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol,是指中和热,
(1)0.1molBa(OH)2中含有0.2mol氢氧根离子,和足量稀硝酸反应,生成0.2mol水,放热应为57.3KJ/mol×0.2mol=11.5KJ,故答案为:11.5;
(2)中和热之所以要求强酸强碱中和,是因为弱酸弱碱没有完全电离,电离时需要吸收热量,醋酸是弱酸,所以,1mol醋酸与1molNaOH反应放出的热量小于57.3KJ,故答案为:小于;CH3COOH的电离过程吸热;
(3)0.5moL/L的H2SO4硫酸是强酸的稀溶液,1mol/L的NaOH溶液是强碱的稀溶液,其反应生成1mol水时是中和热,硫酸过量,能将1molNaOH完全中和,生成1mol水,放出热量为57.3KJ,故答案为:等于;H2SO4过量,n(NaOH)=1 mol,生成1 mol H2O.
(1)0.1molBa(OH)2中含有0.2mol氢氧根离子,和足量稀硝酸反应,生成0.2mol水,放热应为57.3KJ/mol×0.2mol=11.5KJ,故答案为:11.5;
(2)中和热之所以要求强酸强碱中和,是因为弱酸弱碱没有完全电离,电离时需要吸收热量,醋酸是弱酸,所以,1mol醋酸与1molNaOH反应放出的热量小于57.3KJ,故答案为:小于;CH3COOH的电离过程吸热;
(3)0.5moL/L的H2SO4硫酸是强酸的稀溶液,1mol/L的NaOH溶液是强碱的稀溶液,其反应生成1mol水时是中和热,硫酸过量,能将1molNaOH完全中和,生成1mol水,放出热量为57.3KJ,故答案为:等于;H2SO4过量,n(NaOH)=1 mol,生成1 mol H2O.
点评:本题考查学生对于中和热的理解及有关计算等,难度不大,注意强酸、强碱的稀溶液中和热为57.3kJ/mol.

练习册系列答案
相关题目
常温下,分别将4块形状相同,质量均为7g的铁片同时放入下列4种溶液中,产生气体速率最大的是( )
| A、150mL 2mol?L-1盐酸 |
| B、150mL 2mol?L-1硫酸 |
| C、500mL 3mol?L-1盐酸 |
| D、500mL 18.4mol?L-1硫酸 |
下列反应中,不属于放热反应的是( )
| A、木炭燃烧 |
| B、生石灰与水反应 |
| C、酸碱中和反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是( )
| A、加入铜粉,v(H2)增大 |
| B、加入NaCl固体,会增大Cl-浓度,从而使v(H2)增大 |
| C、加入NaHSO4固体v(H2)不变 |
| D、加入水,锌不与水反应,v(H2)不变 |
下列化学用语说法正确的是( )
A、甲基的电子式: | ||
B、乙烯的比例模型: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、次氯酸的结构式:H─O─Cl |
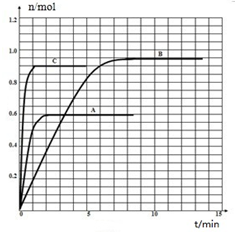
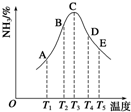 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图: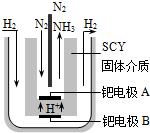 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.