题目内容
将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4═Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A、一定产生BaSO3沉淀 |
| B、一定产生BaSO4沉淀 |
| C、产生的不全是BaSO4沉淀 |
| D、一定有SO3逸出 |
考点:二氧化硫的化学性质,含硫物质的性质及综合应用
专题:元素及其化合物
分析:混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,注意H2SO3酸性小于HCl.
解答:
解:混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,则没有SO3逸出;
H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀.
故选B.
H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀.
故选B.
点评:本题考查二氧化硫的性质,题目难度中等,本题注意SO3和SO2性质的区别,注意H2SO3酸性小于HCl和H2SO4,则不能与BaCl2溶液反应,得不到BaSO3沉淀.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中,不属于放热反应的是( )
| A、木炭燃烧 |
| B、生石灰与水反应 |
| C、酸碱中和反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
在水溶液中能量共存的一组离子是( )
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是( )
| A、加入铜粉,v(H2)增大 |
| B、加入NaCl固体,会增大Cl-浓度,从而使v(H2)增大 |
| C、加入NaHSO4固体v(H2)不变 |
| D、加入水,锌不与水反应,v(H2)不变 |
下列化学反应中,属于氧化还原的化合反应是( )
| A、Na2CO3+CaCl2═CaCO3↓+2NaCl | ||||
| B、Fe+CuSO4═Cu+FeSO4 | ||||
C、2NaHCO3
| ||||
| D、Na2O2+SO2═Na2SO4 |
与图中相对应的叙述是( )
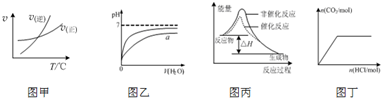

| A、由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 |
| B、图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸 |
| C、图丙表示该反应为放热反应,且催化剂能改变反应的焓变 |
| D、图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |
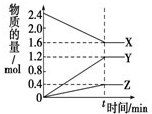 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为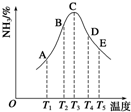 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图: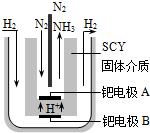 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.