题目内容
已知:A为淡黄色固体,E、X常温下为无色无味气体,A、B、C、D含有相同的金属离子,其转化关系如图1(部分产物已略去).
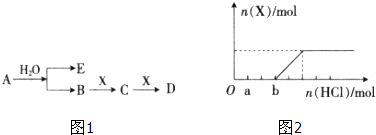
请回答下列问题:
(1)B中所含化学键的类型是 ;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式 .
(3)C也可转化为B,写出该转化的化学方程式 ;
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图2(忽略气体的溶解和HCl的挥发).请回答:a点溶液中所含溶质的化学式为 ,b点溶液中各离子浓度由大到小的关系是 .
(5)①25℃时,将C溶液与氢氧化钡溶液混合可得不溶物F,F的Ksp=2.5×10-9.现将该沉淀放入0.5mol?L-1的BaCl2溶液中,其Ksp (填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为 mol?L-1.
②已知25℃时硫酸钡的Ksp=1.0×10-10,若向20mL硫酸钡的饱和溶液中逐滴加入8.0×10-4mol/L的C溶液20mL,能否产生沉淀 (填“能”或“否”).
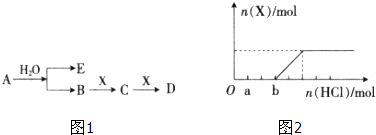
请回答下列问题:
(1)B中所含化学键的类型是
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
(3)C也可转化为B,写出该转化的化学方程式
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图2(忽略气体的溶解和HCl的挥发).请回答:a点溶液中所含溶质的化学式为
(5)①25℃时,将C溶液与氢氧化钡溶液混合可得不溶物F,F的Ksp=2.5×10-9.现将该沉淀放入0.5mol?L-1的BaCl2溶液中,其Ksp
②已知25℃时硫酸钡的Ksp=1.0×10-10,若向20mL硫酸钡的饱和溶液中逐滴加入8.0×10-4mol/L的C溶液20mL,能否产生沉淀
考点:无机物的推断,难溶电解质的溶解平衡及沉淀转化的本质
专题:推断题,电离平衡与溶液的pH专题
分析:E、X常温下为无色无味气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,据此解答.
解答:
解:E、X常温下为无色无味气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,
(l)B为NaOH,含有离子键、共价键,
故答案为:离子键、共价键;
(2)常温常压下,7.8g Na2O2与足量的水充分反应放出热量a kJ,2mol Na2O2完全反应方程式的热量=a kJ×
=20a kJ,反应热化学方程式为:2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol,
故答案为:2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol;
(3)碳酸钠也可转化为氢氧化钠,该转化的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上产生气体之前消耗盐酸与产生二氧化碳消耗盐酸体积之比=3:2,所以溶液中还存在NaOH,说明原溶液中为NaOH、Na2CO3,结合方程式可知,溶液中n(NaOH):n(Na2CO3)=1:2,故a点是氢氧化钠恰好与盐酸反应碳酸钠未反应,a点时溶液中的溶质是Na2CO3和NaCl,
b点时,碳酸钠恰好转化为碳酸氢钠,b点溶液中的溶质是NaHCO3和NaCl,且n(NaHCO3):n(NaCl)=2:3,钠离子和氯离子不水解,根据元素守恒知c(Na+)>c(Cl-)>c(HCO3-),NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),
故答案为:Na2CO3和NaCl;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(5)①F是BaCO3,温度不变,溶度积常数不变,溶液中c(Ba2+)≈0.5mol/L,则溶液中c(CO32-)=
mol/L=5×10-9mol/L,
故答案为:不变;5×10-9;
②已知25℃时硫酸钡的Ksp=1.0×10-10,若向20mL硫酸钡的饱和溶液中逐滴加入8.0×10-4mol/L的Na2CO3溶液20mL,混合后溶液中c(Ba2+)≈
×
mol/L=5.0×10-6mol/L,则溶液中c(CO32-)=
×8.0×10-4mol/L=4.0×10-4mol/L,而5.0×10-6×4.0×10-4=2.0×10-9<2.5×10-9,故没有沉淀产生,
故答案为:否.
(l)B为NaOH,含有离子键、共价键,
故答案为:离子键、共价键;
(2)常温常压下,7.8g Na2O2与足量的水充分反应放出热量a kJ,2mol Na2O2完全反应方程式的热量=a kJ×
| 2mol×78g/mol |
| 7.8g |
故答案为:2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol;
(3)碳酸钠也可转化为氢氧化钠,该转化的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上产生气体之前消耗盐酸与产生二氧化碳消耗盐酸体积之比=3:2,所以溶液中还存在NaOH,说明原溶液中为NaOH、Na2CO3,结合方程式可知,溶液中n(NaOH):n(Na2CO3)=1:2,故a点是氢氧化钠恰好与盐酸反应碳酸钠未反应,a点时溶液中的溶质是Na2CO3和NaCl,
b点时,碳酸钠恰好转化为碳酸氢钠,b点溶液中的溶质是NaHCO3和NaCl,且n(NaHCO3):n(NaCl)=2:3,钠离子和氯离子不水解,根据元素守恒知c(Na+)>c(Cl-)>c(HCO3-),NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),
故答案为:Na2CO3和NaCl;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(5)①F是BaCO3,温度不变,溶度积常数不变,溶液中c(Ba2+)≈0.5mol/L,则溶液中c(CO32-)=
| 2.5×10-9 |
| 0.5 |
故答案为:不变;5×10-9;
②已知25℃时硫酸钡的Ksp=1.0×10-10,若向20mL硫酸钡的饱和溶液中逐滴加入8.0×10-4mol/L的Na2CO3溶液20mL,混合后溶液中c(Ba2+)≈
| 1 |
| 2 |
| 1.0×10-10 |
| 1 |
| 2 |
故答案为:否.
点评:本题考查了无机物推断,涉及化学键、热化学方程式、离子浓度大小比较、溶度积有关计算等知识点,(4)为易错点,清楚发生的反应判断原溶液中溶质及物质的量关系是关键,题目难度中等.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
铜锌原电池(如图)工作时,下列叙述正确的是( )
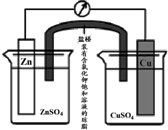

| A、在外电路中,电流从Zn极流向Cu极 |
| B、盐桥中的Cl-移向CuSO4溶液 |
| C、当负极减小65g时,正极增加65g |
| D、电池的总反应为 Zn+Cu2+=Zn2++Cu |
常温下,分别将4块形状相同,质量均为7g的铁片同时放入下列4种溶液中,产生气体速率最大的是( )
| A、150mL 2mol?L-1盐酸 |
| B、150mL 2mol?L-1硫酸 |
| C、500mL 3mol?L-1盐酸 |
| D、500mL 18.4mol?L-1硫酸 |
为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是( )
| A、加入铜粉,v(H2)增大 |
| B、加入NaCl固体,会增大Cl-浓度,从而使v(H2)增大 |
| C、加入NaHSO4固体v(H2)不变 |
| D、加入水,锌不与水反应,v(H2)不变 |
 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为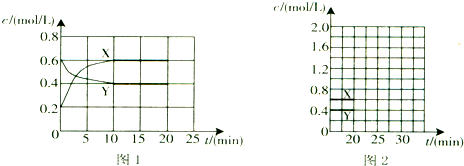
 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图: