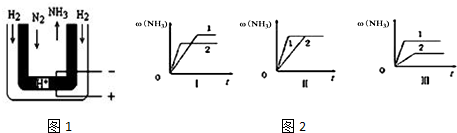
题目内容
8.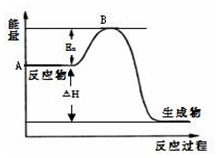 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:(1)图中A点表示反应物的总能量,a=-198KJ•mol-1.
(2)Ea的大小对该反应的△H无(填“有”或“无”)影响.
(3)已知常温常压下单质硫的燃烧热为296kJ•mol-1,由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为1185KJ.
分析 (1)根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)物质的活化能的大小与反应热无关;加入催化剂能降低物质的活化能;
(3)依据燃烧热的概念及盖斯定律解答.
解答 解:(1)图中A点表示反应物的总能量,因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:反应物的总能量;-198KJ•mol-1;
(2)因物质的活化能的大小与反应热无关;加入催化剂能降低物质的活化能,则Ea降低,故答案为:无;
(3)单质硫的燃烧热为296kJ•mol-1,因燃烧热概念要求必须是lmol物质完全燃烧,则热化学方程式为:S(s)+O2=SO2(g)△H=-296kJ•mol-1,由2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,根据盖斯定律可知:2S(s)+)+3O2(g)=2SO3(g)△H=-296×2-198=-790KJ•mol-1,所以生成3mol SO3(g),放出的总热量为$\frac{3×790}{2}$=1185KJ,故答案为:1185KJ.
点评 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,注意活化能与反应热的关系,注意燃烧热的定义,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.通过以下反应均可获取H2.下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)△H1=571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)△H2=131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)△H3=206.1kJ•mol-1.
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)△H1=571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)△H2=131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)△H3=206.1kJ•mol-1.
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应②中,反应物的键能大于生成物的键能 |
19.下列不能通过单质间反应而制得的物质是( )
| A. | CuCl2 | B. | CuO | C. | FeCl2 | D. | HCl |
3.下列说法正确的是( )
| A. | 丙烷是直链烃,所以分子中3个碳原子也在一条直线上 | |
| B. | 丙烯所有原子均在同一平面上 | |
| C. | 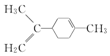 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. |  至少有16个原子共平面,至少8原子共线 至少有16个原子共平面,至少8原子共线 |
17.X、Y、Z、M、N是原子序数依次增大的短周期主族元素,其中X与Z为同族元素,Y和M为同族元素,且Y与M的核外电子数之和为X和Z元素的核外电子数之和的2倍,下列说法正确的是( )
| A. | 原子半径:Z>M>N>X>Y | B. | M与N形成的化合物中N显正价 | ||
| C. | 单质沸点:Z>M>N>Y>X | D. | 最高正价:N>M=Y>Z=X |
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取: