题目内容
1.一定条件下,向容器的体积为4L的密闭容器中通入1mol N2和3mol H2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后.试回答下列问题: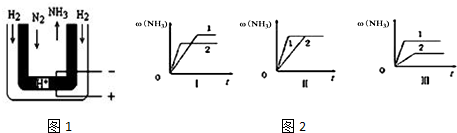
(1)该条件下,反应的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$.达到平衡后,若其它条不变,升高体系的温度,平衡常数K将减小(填“增大”、“减小”或“不变”).
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),氮气的转化率将不变(“增大”、“减小”或“不变”,下同).若再通入1mol N2和3mol H2,氮气的转化率将增大.
(3)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图1中黑细点)能传导H+,则阴极的电极反应式为N2+6e-+6H+=2NH3
(4)三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图2.下列说法正确的是abc;
a.图Ⅰ可能是不同温度对反应的影响,且T2>T1
b.图Ⅲ可能是不同压强对反应的影响,且p1>p2
c.图Ⅱ可能是同温同压下,催化剂性能,1>2.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;正反应为放热反应,升高温度平衡逆向移动;
(2)在恒容条件下,向容器中通入氦气,参加反应的气体的浓度不变;若再通入1mol N2和3mol H2,相当于增大压强,平衡正向移动;
(3)阴极发生还原反应,氮气在阴极获得电子,与电解质传导的H+结合生成氨气;
(4)a.升高温度反应速率加快,平衡逆向移动;
b.增大压强反应速率加快,平衡右移;
c.使用催化剂,不影响平衡移动,催化剂性能越大,反应速率越快.
解答 解:(1)N2(g)+3H2(g)?2NH3(g)的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;减小;
(2)在恒容条件下,向容器中通入氦气,参加反应的气体的浓度不变;若再通入1mol N2和3mol H2,相当于增大压强,平衡正向移动,则转化率增大,
故答案为:不变;增大;
(3)阴极发生还原反应,氮气在阴极获得电子,与电解质传导的H+结合生成氨气,阴极电极反应式为:N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3;
(4)a.升高温度反应速率加快,平衡逆向移动,氨气的体积分数减小,故a正确;
b.增大压强反应速率加快,达到平衡用时少,平衡右移,氨气的体积分数增大,故b正确;
c.使用催化剂,不影响平衡移动,催化剂性能越大,反应速率越快,故c正确.
故答案为:abc.
点评 本题考查较为综合,为高考常见题型,涉及化学平衡的计算与影响因素、化学平衡图象、电解原理等,题目难度中等,(4)中注意利用先拐先平数值大原则与定二议一法分析图象.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. |  | B. |  | ||
| C. |  | D. |  |
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
②已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-169kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ•mol-1.
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图1.
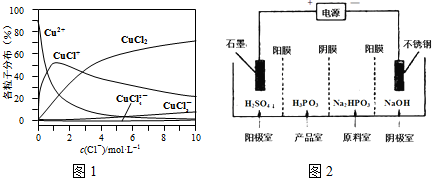
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl+═Cu2++Cl-(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
②电解Na2HPO3溶液可得到亚磷酸,装置如2图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
(1)已知:
①2H2(g)+O2(g)═2H2O(g)△H=-484.0kJ/mol
②CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
请写出甲醇的燃烧热的热化学方程式,CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-765kJ/mol该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})}{c(C{H}_{3}OH){c}^{\frac{3}{2}}({O}_{2})}$.
(2)向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是ad.
a、混合气体的平均式量保持不变 b、CO2和H2的转化率相等
c、CO2和H2的体积分数保持不变 d、混合气体的密度保持不变
e、1mol CO2生成的同时有1mol C-H键断裂
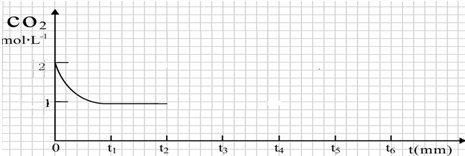
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
(3)改变条件,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.反应过程中部分数据如表:
| 反应条件 | 反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
②在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
(4)用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极的反应式为CO2+8e-+8H+=CH4+2H2O.
 现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:
现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:| 序号 | 待测液体积(ml) | 所消耗标准盐酸的体积(ml) | ||
| 滴定前 | 滴定后 | 消耗体积 | ||
| 1 | 25.00 | 1.00 | 27.30 | 26.30 |
| 2 | 25.00 | ? | ? | ? |
| 3 | 25.00 | 1.50 | 27.84 | 26.34 |
(2)如图表示第二组实验时滴定前后滴定管中的液面位置,则该次所用标准盐酸的体积为24.50mL,根据所给数据,计算该氢氧化钠溶液的浓度为0.02632mol/L(保留4位有效数字).
(3)若在实验过程中存在如下操作,会导致实验测定结果如何?(填“偏大”“偏小”“无影响”)
①滴定时酸式滴定管用蒸馏水洗涤后未用标准液润洗,偏大.
②滴定过程中,不小心将锥形瓶内液体摇到瓶外,偏小.
③锥形瓶用蒸馏水洗涤后为干燥直接装待测液,无影响.
④量取待测液时,刚开始尖嘴处有气泡后来消失,偏小.
⑤滴定前平视读数,滴定后仰视读数,偏大.
| A. | 两种 | B. | 三种 | C. | 四种 | D. | 五种 |
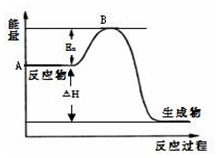 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
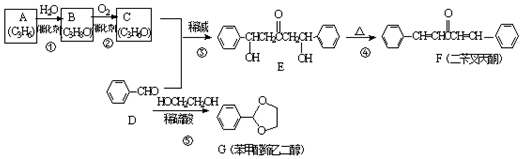
 ;A加聚产物的结构简式是
;A加聚产物的结构简式是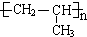 .
.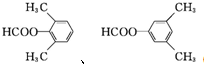 .
.