题目内容
2.150℃时碳酸铵完全分解产生的气态混合物,其密度是同条件下氢气密度12 倍 (碳酸铵分解会生成氨气,水和二氧化碳).分析 NH4)2CO3发生反应:(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O↑+CO2↑,由方程式可知,1mol(NH4)2CO3分解生成4mol混合气体,4mol混合气体的质量等于1mol(NH4)2CO3的质量,先根据$\frac{M}{n}$=$\frac{{m}_{总}}{{n}_{总}}$计算混合气体的平均摩尔质量,然后利用密度之比等于摩尔质量之比计算,以此解答该题.
解答 解:因(NH4)2CO3发生反应:(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O↑+CO2↑
方程式可知,1mol(NH4)2CO3分解生成4mol混合气体,4mol混合气体的质量等于1mol(NH4)2CO3的质量,
则混合气平均摩尔质量为=$\frac{1mol×96g/mol}{4mol}$=24g/mol,
因气体密度之比等于摩尔质量之比,所以混合气的密度是相同条件下的氢气密度的$\frac{24g/mol}{2g/mol}$=12倍,
故答案为:12.
点评 本题结合铵盐的化学性质,考查了平均摩尔质量、相对密度的计算等,侧重考查学生的分析能力和计算能力,难度不大,注意基础知识的理解掌握.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
19.工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
下列说法正确的是( )
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 衡 时 数据 | CH3OH的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | a1 | a2 | a3 | |
| A. | 2 c1>c3 | B. | |a|+|b|=90.8 | C. | 2 p2<p3 | D. | a1+a3<1 |
10.如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)
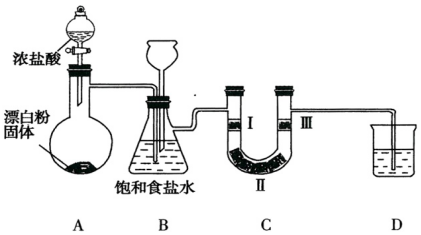
已知:装置A是氯气的发生装置,反应的化学方程式为:
Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
据此回答下列问题:
(1)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(2)装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:B中长颈漏斗中液面上升.
(3)装置C的目的是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是d(填序号).
(4)装置D的作用是吸收多余的氯气,防止污染空气,则烧杯中的溶液是NaOH溶液,写出所发生反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
(5)若所用浓盐酸的浓度为10mol/L,求产生2.24L(标准状况)Cl2时,发生反应的盐酸为40mL.

已知:装置A是氯气的发生装置,反应的化学方程式为:
Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
据此回答下列问题:
(1)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(2)装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:B中长颈漏斗中液面上升.
(3)装置C的目的是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是d(填序号).
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)若所用浓盐酸的浓度为10mol/L,求产生2.24L(标准状况)Cl2时,发生反应的盐酸为40mL.
12.不能用单质直接反应得到的是( )
| A. | NaCl | B. | MgCl2 | C. | AlC13 | D. | FcC12 |