题目内容
11.某化学兴趣小组为检验碳和浓硫酸反应生成的产物,设计如图装置,请回答: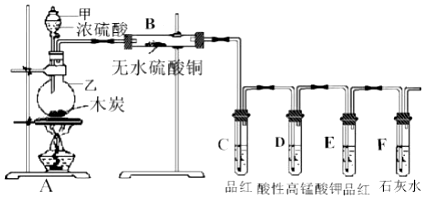
(1)指出仪器名称:甲分液漏斗; 乙圆底烧瓶;
(2)乙仪器中发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)证明有二氧化碳产生的实验现象是E中品红溶液不褪色,F中澄清石灰水变浑浊;
(4)若把B玻璃管移到F试管后连接,是否可行不可行(填“可行”或“不可行”),理由是气体通过水溶液时,会带出水汽,干扰产物中水的确定.
分析 A中加热条件下,浓硫酸和碳发生氧化还原反应生成二氧化碳、二氧化硫和水,B中无水硫酸铜用于检验水,C中品红用于检验二氧化硫,D用于除去二氧化硫,二氧化硫与高锰酸钾发生氧化还原反应,E用于检验品红是否除尽,F可用于检验是否生成二氧化碳,可观察到石灰水变浑浊,以此解答该题.
解答 解:(1)依据装置图中操作的要求和图形分析,浓硫酸与木炭的反应需要把浓硫酸加入木炭加热反应,所以甲为分液漏斗,乙为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
(2)浓硫酸具有强氧化性,在加热条件下与木炭发生氧化还原反应,生成二氧化碳、二氧化硫、水,反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)装置B是检验有水生成的装置,无水硫酸铜变蓝证明生成产物中含有水,气体通过C验证二氧化硫的生成,通过D是除去二氧化硫气体,E是验证二氧化硫气体是否除净,便于利用F装置检验二氧化碳气体的存在,要求气体通过E品红后不褪色,通过F石灰水变浑浊,才能证明气体中含有二氧化碳气体,
故答案为:E中品红溶液不褪色,F中澄清石灰水变浑浊;
(4)溶液中含有水分,若若把B玻璃管移到F试管后连接,气体通过水溶液时会带出水蒸气,影响了水的测定,所以该方法不可行,
故答案为:不可行;气体通过水溶液时,会带出水汽,干扰产物中水的确定.
点评 本题考查浓硫酸的性质实验,为高考常见题型和高频考点,侧重考查学生的分析能力和实验能力,注意把握浓硫酸的强氧化性,题目难度中等,明确气体的性质及检验的先后顺序为解答关键,注意掌握浓硫酸的化学性质,能够正确书写浓硫酸与碳反应化学方程式.

(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→A、B→C、D→E:广口瓶Ⅱ中的试剂为饱和食盐水.
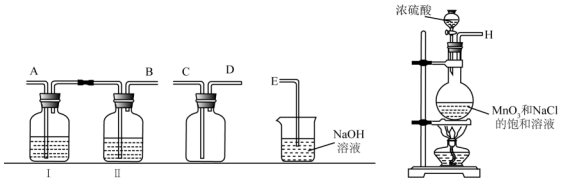
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)某学生设计如下实验进一步探究SO2与漂粉精的反应:
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
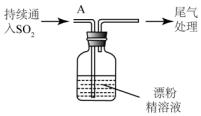 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
②该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是排除氯气干扰
③推测ii中溶液变为黄绿色,是由于产生了Cl2(写化学式),iii中产生的大量白色沉淀应为CaSO4(写化学式)
| A. | 金刚石 | B. | 硬铝 | C. | 不锈钢 | D. | 青铜 |
 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题: