题目内容
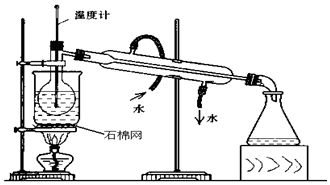
17.用98%的浓H2SO4(ρ=1.84g/cm3)配制250ml 0.5mol/L的稀H2SO4的操作简单可概括为计算、称称量、溶解、移液、洗涤、定容、摇匀、装瓶.请按要求填空:(1)所需浓H2SO4的体积为6.8ml.
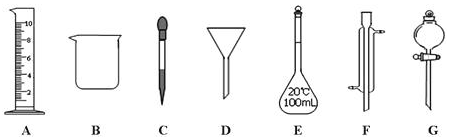
(2)除量筒和胶头滴管外还需用到的玻璃仪器有:烧杯 250ml容量瓶 玻璃棒.
(3)实验中造成所配溶液浓度偏高的原因可能是B.
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线.
分析 (1)根据c=$\frac{1000ρω}{M}$求出浓硫酸的物质的量浓度,然后根据稀释定律来计算所需浓硫酸的体积;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 Ⅱ、(1)浓硫酸的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设所需浓硫酸的体积为VmL,根据稀释定律可知:18.4mol/L×VmL=0.5mol/L×250mL,解得V=6.8mL;
故答案为:6.8ml;
(2)配制一定物质的量浓度溶液的步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故除量筒、胶头滴管外,还必须用到的仪器有烧杯 250ml容量瓶 玻璃棒,
故答案为:烧杯 250ml容量瓶 玻璃棒;
(3)A.容量瓶中原来含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故A不选;
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容,冷却后溶液体积偏小,溶液浓度偏高,故B选;
C.烧杯没有洗涤,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.向容量瓶中加水定容时眼睛一直仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:B.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
14.2.48g铁铜合金完全溶解于80mL 4.0mol•L-1稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是( )
| A. | 取反应后溶液,滴入几滴KSCN溶液,无血红色出现 | |
| B. | 该合金中铁与铜的物质的量之比是1:2 | |
| C. | 反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol•L-1 | |
| D. | 向反应后的溶液中加入2.0 mol•L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL |
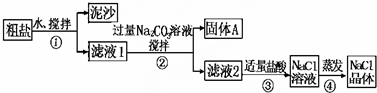
8.某同学用某种粗盐进行提纯实验,步骤如图.
请回答:
(1)步骤①和②的操作相同,其名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成固体(或溶液)飞溅,当蒸发皿中有较多量固体出现时,应停止加热(或熄灭酒精灯),用余热使水分蒸干.
(3)猜想和验证,补充完整相应的操作、现象和结论:

请回答:
(1)步骤①和②的操作相同,其名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成固体(或溶液)飞溅,当蒸发皿中有较多量固体出现时,应停止加热(或熄灭酒精灯),用余热使水分蒸干.
(3)猜想和验证,补充完整相应的操作、现象和结论:
| 猜想 | 验证的操作 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含有BaCO3 | 取少量固体A于试管中,先滴入过量稀硝酸(或稀盐酸),再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
| 猜想Ⅱ:最后制得的NaCl晶体中还有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, 先滴入BaCl2溶液,再滴入过量稀HNO3 | 有白色沉淀 | 猜想Ⅱ成立 |
9.下列物质中互为同分异构体的是( )
| A. | 13C 与 14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3 与 CH3CH(CH3)2 |
7.有关碳元素及其化合物的化学用语正确的是( )
| A. | 碳--12 原子:612C | B. | C原子最外层电子的轨道表示式: | ||
| C. | 醋酸钠的分子式:C2H3O2Na | D. | 2-甲基-1-丙醇的结构简式: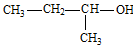 |