题目内容
10.如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)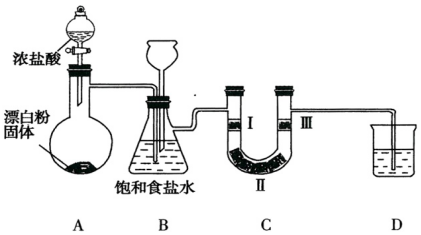
已知:装置A是氯气的发生装置,反应的化学方程式为:
Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
据此回答下列问题:
(1)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(2)装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:B中长颈漏斗中液面上升.
(3)装置C的目的是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是d(填序号).
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)若所用浓盐酸的浓度为10mol/L,求产生2.24L(标准状况)Cl2时,发生反应的盐酸为40mL.
分析 (1)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大;
(2)据监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大来分析;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)据氯气有毒不能直接排放到空气中,应用碱吸收来分析;
(5)根据MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中的化学计量数之比等于参加反应的物质的量之比来计算.
解答 解:(1)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;
故答案为:除去Cl2中的HCl;
(2)监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,气体将溶液压入长颈漏斗B中,形成水柱;
故答案为:B中长颈漏斗中液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中ab的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性;c中II为固体干燥剂,不能为浓硫酸,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,故答案为:d;
(4)氯气有毒不能直接排放到空气中,故D的作用是吸收多余的氯气,防止污染空气,氯气是酸性气体,故用碱液NaOH溶液吸收,氯气与氢氧化钠反应生产氯化钠,次氯酸钠和水,反应为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:吸收多余的氯气,防止污染空气;NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O;
(5)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;
4mol 22.4L
0.4mol 2.24L
∵n(HCl)=c(HCl)V n(HCl)=0.4mol c(HCl)=10mol/L∴V=40mL,
故答案为:40.
点评 本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,是对所学知识的综合运用,注意基础知识的掌握,本题难度中等.

| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 20 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
②915℃、2.0MPa时E的转化率为60%
③该反应的△S<0
④K(815℃)<K(1000℃)
上述①~④中不正确的有( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→A、B→C、D→E:广口瓶Ⅱ中的试剂为饱和食盐水.
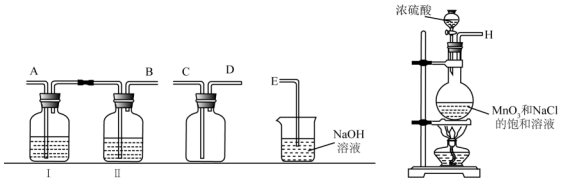
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)某学生设计如下实验进一步探究SO2与漂粉精的反应:
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
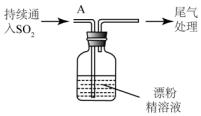 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
②该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是排除氯气干扰
③推测ii中溶液变为黄绿色,是由于产生了Cl2(写化学式),iii中产生的大量白色沉淀应为CaSO4(写化学式)
| A. | 金刚石 | B. | 硬铝 | C. | 不锈钢 | D. | 青铜 |
 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题: 实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: