题目内容
19.如图中A~H都是中学化学中常见的物质,其中,常温下A能使铁或铝钝化,B是固体非金属单质,C为水,D是一种能使品红溶液褪色的无色气体,F是金属单质,G可以用作耐火材料,它们之间有如下转化关系.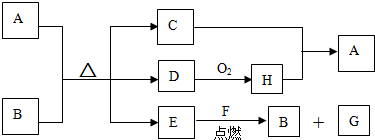
(1)写出下列物质的化学式:ECO2,HSO3.
(2)写出A溶液与B反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O.
试写出E与F的反应方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
分析 常温下A能使铁或铝钝化,A为浓硝酸或浓硫酸,B是固体非金属单质,C为水,D是一种能使品红溶液褪色的无色气体,则A为浓硫酸,B为碳,D为SO2,E为CO2,H为SO3,F是金属单质,G可以用作耐火材料,则F为Mg,G为MgO,据此解答
解答 解:常温下A能使铁或铝钝化,A为浓硝酸或浓硫酸,B是固体非金属单质,C为水,D是一种能使品红溶液褪色的无色气体,则A为浓硫酸,B为碳,D为SO2,E为CO2,H为SO3,F是金属单质,G可以用作耐火材料,则F为Mg,G为MgO.
(1)E为CO2,H为SO3,故答案为:CO2;SO3;
(2)A溶液与B反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O,
E与F的反应方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查无机物推断,物质的性质及转化中特殊反应为推断突破口,注意Mg与二氧化碳的反应,熟练掌握元素化合物性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.用0.1000mol•L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 | |
| B. | 应该选择酚酞作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
14.以下物质间的每步转化通过一步反应不能实现的是( )
| A. | S→SO3→H2SO4→SO2 | B. | N2→NO→NO2→HNO3 | ||
| C. | Na→Na2O→NaOH→Na2CO3 | D. | Al→Al2O3→Al2(SO4)3→Al(OH)3 |
4.常温下,某酸HA溶液和某碱BOH溶液的pH之和为14,两溶液混合后,溶液的pH=7,下列判断中合理的是( )
| 编号 | HA | BOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HA)<V(BOH) |
| ② | 强酸 | 强碱 | V(HA)=V(BOH) |
| ③ | 强酸 | 弱碱 | V(HA)>V(BOH) |
| ④ | 弱酸 | 强碱 | V(HA)>V(BOH) |
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
11.下列说法不正确的是( )
| A. | 铅蓄电池在放电过程中,电池反应液的pH将变小 | |
| B. | 相同条件下,结合质子的能力:OH->ClO->CH3COO- | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 | |
| D. | 在氯化银悬浊液中加入NaBr溶液,沉淀由白色转变为淡黄色,说明Ksp(AgCl)>Ksp(AgBr) |
8.下列气体不能用排气法收集的是( )
| A. | Cl2 | B. | CO2 | C. | NH3 | D. | NO |