题目内容
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:(1)该硫酸的物质的量浓度为
(2)配制250mL 0.92mol?L-1的稀硫酸需取该硫酸
(3)配制时必需的玻璃仪器有:
(4)定容时,若加入的水超过刻度线,必须采取的措施是
(5)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:
②容量瓶用水洗净后未烘干:
③定容时俯视容量瓶的刻度线:
(6)在配置过程中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解.
D.将准确量取的18.4mol?L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据c=
计算该硫酸的物质的量浓度;
(2)根据稀释定律c1V1=c2V2计算需要浓硫酸的体积;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)定容时,若加入的水超过刻度线,导致所配溶液浓度偏低,需要重新配制;
(5)分析操作对溶质物质的量、溶液体积的影响,根据c=
判断对所配溶液浓度影响;
(6)根据实验操作的规范性进行判断.
| 1000ρw |
| M |
(2)根据稀释定律c1V1=c2V2计算需要浓硫酸的体积;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)定容时,若加入的水超过刻度线,导致所配溶液浓度偏低,需要重新配制;
(5)分析操作对溶质物质的量、溶液体积的影响,根据c=
| n |
| V |
(6)根据实验操作的规范性进行判断.
解答:
解:(1)密度为1.84g/mL、质量分数为98%的硫酸,其物质的量浓度=
mol/L=18.4mol/L,故答案为:18.4mol/L;
(2)设配制250mL 0.92mol?L-1的稀硫酸需取浓硫酸的体积为V mL,根据稀释定律,则:
250mL×0.92mol/L=V mL×18.4 mol/L,解得V=12.5,故答案为:12.5;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶,
故答案为:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)定容时,若加入的水超过刻度线,导致所配溶液浓度判断,需要重新配制,故答案为:重新配制;
(5)①转移溶液后,未洗涤烧杯,移入容量瓶内硫酸物质的量减小,所配溶液浓度偏低;
②溶液配制需加水定容,容量瓶用水洗净后未烘干对所配溶液浓度无影响;
③定容时俯视容量瓶的刻度线,液面在刻度线下方,溶液体积偏小,所配溶液浓度偏高,
故答案为:偏低;无影响;偏高;
(6)A、使用容量瓶前检查它是否漏水,否则配制溶液浓度不准确,故A正确;
B、容量瓶用蒸馏水洗净后,不能用待配制的溶液洗涤,否则,溶质的物质的量偏大,配制溶液浓度偏高,故B错误;
C、氢氧化钠具有腐蚀性,应该放在小烧杯中称量,故C错误;
D、容量瓶不能用来稀释溶液,故D错误;
E、定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故E正确;
故选BCD.
| 1000×1.84×98% |
| 98 |
(2)设配制250mL 0.92mol?L-1的稀硫酸需取浓硫酸的体积为V mL,根据稀释定律,则:
250mL×0.92mol/L=V mL×18.4 mol/L,解得V=12.5,故答案为:12.5;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶,
故答案为:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)定容时,若加入的水超过刻度线,导致所配溶液浓度判断,需要重新配制,故答案为:重新配制;
(5)①转移溶液后,未洗涤烧杯,移入容量瓶内硫酸物质的量减小,所配溶液浓度偏低;
②溶液配制需加水定容,容量瓶用水洗净后未烘干对所配溶液浓度无影响;
③定容时俯视容量瓶的刻度线,液面在刻度线下方,溶液体积偏小,所配溶液浓度偏高,
故答案为:偏低;无影响;偏高;
(6)A、使用容量瓶前检查它是否漏水,否则配制溶液浓度不准确,故A正确;
B、容量瓶用蒸馏水洗净后,不能用待配制的溶液洗涤,否则,溶质的物质的量偏大,配制溶液浓度偏高,故B错误;
C、氢氧化钠具有腐蚀性,应该放在小烧杯中称量,故C错误;
D、容量瓶不能用来稀释溶液,故D错误;
E、定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故E正确;
故选BCD.
点评:本题考查一定物质的量浓度溶液配制,难度中等,注意根据c=
理解溶液配制原理与误差分析.
| n |
| V |

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通的肥皂洗涤时,会发现黄色污渍变为红色,经水漂洗后红色又变黄色.据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用( )
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
用下列装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 |  | 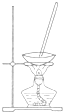 |  | 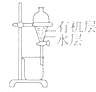 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
| A、A | B、B | C、C | D、D |
下列实验方案设计正确的是( )
| A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C、将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D、检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
下列说法正确的是( )
| A、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换 |
| B、Na2O2中阴阳离子数数目之比为1:1 |
| C、Cl2与SO2均能使品红褪色,说明二者均有氧化性 |
| D、NO能够与人体里的血红蛋白结合,造成人体缺氧中毒 |
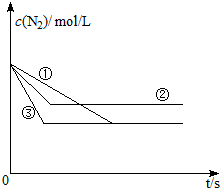 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 试回答:
试回答: