题目内容
向10mL 1.5mol/L的硫酸铝溶液加入30mL NaOH溶液,充分反应后得到1.56g沉淀,则NaOH溶液的物质的量浓度是( )
| A、1mol/L |
| B、2mol/L |
| C、5mol/L |
| D、3.3mol/L |
考点:有关过量问题的计算
专题:
分析:10mL 1.5mol/L的硫酸铝中铝离子的物质的量=0.01L×1.5mol/L×2=0.03mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.03mol×78g/mol=2.34g>1.56g,说明有两种情况:一为铝离子沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算NaOH溶液的物质的量的浓度.
解答:
解:10mL 1.5mol/L的硫酸铝中铝离子的物质的量=0.01L×1.5mol/L×2=0.03mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.03mol×78g/mol=2.34g>1.56g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n[Al(OH)3]=
=0.02mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.02mol×3=0.06mol,则c(NaOH)=
=2mol/L,
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.03mol 0.09mol 0.03mol
溶解氢氧化铝为0.03mol-0.02mol=0.01mol
Al(OH)3+OH-═AlO2-+2H2O
0.01mol 0.01mol
则消耗的碱的物质的量为0.09mol+0.01mol=0.1mol,则c(NaOH)=
=3.3mol/L,
故选:BD.
n[Al(OH)3]=
| 1.56g |
| 78g/mol |
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.02mol×3=0.06mol,则c(NaOH)=
| 0.06mol |
| 0.03L |
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.03mol 0.09mol 0.03mol
溶解氢氧化铝为0.03mol-0.02mol=0.01mol
Al(OH)3+OH-═AlO2-+2H2O
0.01mol 0.01mol
则消耗的碱的物质的量为0.09mol+0.01mol=0.1mol,则c(NaOH)=
| 0.1mol |
| 0.03L |
故选:BD.
点评:本题考查方程式的有关计算,涉及过量计算,难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

练习册系列答案
相关题目
短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A、Y的气态简单氢化物的热稳定性比W的强 |
| B、X的最高价氧化物对应水化物的酸性比W的弱 |
| C、Y分别与Z、W形成的化合物均为碱性氧化物 |
| D、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
下列每组反应一定能用同一离子方程式表示的是( )
| A、CaCO3、Na2CO3分别与盐酸反应 |
| B、CuO分别与稀硫酸、稀盐酸、稀硝酸反应 |
| C、H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 |
| D、Na分别与水、稀盐酸反应 |
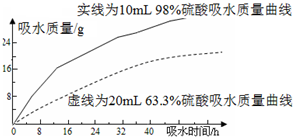 探究浓硫酸的吸水性.某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图.由如图曲线你能得到的实验结论有哪些?(写两点)
探究浓硫酸的吸水性.某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图.由如图曲线你能得到的实验结论有哪些?(写两点)
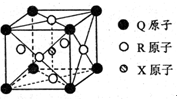 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.