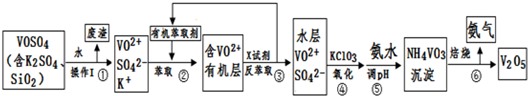
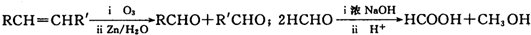题目内容
短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A、Y的气态简单氢化物的热稳定性比W的强 |
| B、X的最高价氧化物对应水化物的酸性比W的弱 |
| C、Y分别与Z、W形成的化合物均为碱性氧化物 |
| D、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
考点:原子结构与元素周期律的关系
专题:
分析:短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最高的元素,则Y是O元素,Z2+与Y2-具有相同的电子层结构,则Z是Mg元素,W与X同主族,X原子的最外层电子数是其内层电子数的2倍,最外层电子数不超过8个、第一层为最外层不超过2个,X原子序数小于Y,则X是C元素,W是Si元素,
A.元素的非金属性越强,其气态氢化物的稳定性越强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.Y是O元素、Z是Mg元素、W是Si元素,SiO2是酸性氧化物;
D.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
A.元素的非金属性越强,其气态氢化物的稳定性越强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.Y是O元素、Z是Mg元素、W是Si元素,SiO2是酸性氧化物;
D.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
解答:
解:短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最高的元素,则Y是O元素,Z2+与Y2-具有相同的电子层结构,则Z是Mg元素,W与X同主族,X原子的最外层电子数是其内层电子数的2倍,最外层电子数不超过8个、第一层为最外层不超过2个,X原子序数小于Y,则X是C元素,W是Si元素,
A.元素的非金属性越强,其气态氢化物的稳定性越强,Y的非金属性大于W,所以Y的气态简单氢化物的热稳定性比W的强,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性X>W,所以X的最高价氧化物对应水化物的酸性比W的强,故B错误;
C.Y是O元素、Z是Mg元素、W是Si元素,SiO2是酸性氧化物,MgO是碱性氧化物,故C错误;
D.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径r(Z)>r(W)>r(X)>r(Y),故D错误;
故选A.
A.元素的非金属性越强,其气态氢化物的稳定性越强,Y的非金属性大于W,所以Y的气态简单氢化物的热稳定性比W的强,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性X>W,所以X的最高价氧化物对应水化物的酸性比W的强,故B错误;
C.Y是O元素、Z是Mg元素、W是Si元素,SiO2是酸性氧化物,MgO是碱性氧化物,故C错误;
D.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径r(Z)>r(W)>r(X)>r(Y),故D错误;
故选A.
点评:本题考查原子结构和元素周期律,明确元素周期律内涵是解本题关键,熟练掌握元素周期律并灵活运用,知道非金属的非金属性与其气态氢化物的稳定性、最高价氧化物的水化物酸性强弱关系,题目难度不大.

练习册系列答案
相关题目
在一定温度下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+O2(g)═
CO2(g)+H2O(l)△H=-445kJ/mol,1molCO和2mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、2346 kJ |
| B、2670 kJ |
| C、1698kJ |
| D、2063 kJ |
某反应过程能量变化如图所示,下列说法正确的是( )
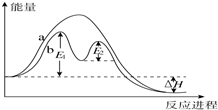

| A、反应过程a有催化剂参与 |
| B、该反应为放热反应,热效应不等于△H |
| C、使用催化剂,可改变该反应的活化能 |
| D、有催化剂条件下,反应的活化能等于E1-E2 |
向10mL 1.5mol/L的硫酸铝溶液加入30mL NaOH溶液,充分反应后得到1.56g沉淀,则NaOH溶液的物质的量浓度是( )
| A、1mol/L |
| B、2mol/L |
| C、5mol/L |
| D、3.3mol/L |
下列粒子浓度关系不正确的是( )
| A、0.1mol/L的醋酸溶液中:c(CH3COOH)>c(H+)>c(CH3COO-) |
| B、0.1mol/L的明矾[KAl(SO4)2?12H2O]溶液中:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
| C、等浓度的Na2CO3与NaHCO3混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
| D、稀硫酸中滴入氨水至中性后所得的溶液中:c(NH4+)=c(SO42-)>c(H+)=c(OH-) |
下列化学反应的离子方程式正确的是( )
| A、往明矾溶液中逐滴加入氢氧化钡溶液至SO42-恰好完全沉淀Al3++2 SO42-+2 Ba2++4 OH-=2 BaSO4↓+AlO2-+2 H2O |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C、用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| D、AgNO3溶液中加入过量的氨水:Ag++NH3?H2O=AgOH↓+NH4+ |