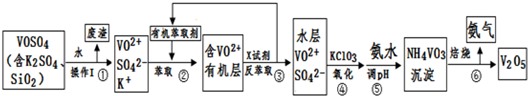
题目内容
X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两对成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W是第三周期中原子半径最小的主族元素,N的核电荷数是W与Z的核电荷数之和.NW3能与Z、Q的氢化物形成配位数为6的配合物,其中两种配体的个数比为2:1,三个W离子位于外界.请回答下列问题:
(1)X、Z、N、W的元素符号分别为 , , , ;
(2)比较Y、Z、Q的第一电离能大小 ;(用元素符号表示)
(3)比较X2Q与ZX3的熔点高低(填化学式) > ;其中Z、Q的氢化物比同主族氢化物的沸点高的原因是 ;
(4)Z、W的最高价氧化物的水化物的酸性较强的是(填化学式) ;
(5)N的价电子排布图为 ;
(6)NW3与Z、Q的氢化物形成的配位数为6的配合物化学式为 .
(1)X、Z、N、W的元素符号分别为
(2)比较Y、Z、Q的第一电离能大小
(3)比较X2Q与ZX3的熔点高低(填化学式)
(4)Z、W的最高价氧化物的水化物的酸性较强的是(填化学式)
(5)N的价电子排布图为
(6)NW3与Z、Q的氢化物形成的配位数为6的配合物化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,则Y为碳元素,Q原子核外的L层中只有两对成对电子,则Q为氧元素,由于Z的核电荷数介于Y、Q之间,所以Z为氮元素,X与Y、Q可以原子个数2:1或1:1形成化合物,则X为氢元素,W是第三周期中原子半径最小的主族元素,则W为氯元素,N的核电荷数是W与Z的核电荷数之和,则N为24号元素,铬元素,据此答题.
解答:
解:X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,则Y为碳元素,Q原子核外的L层中只有两对成对电子,则Q为氧元素,由于Z的核电荷数介于Y、Q之间,所以Z为氮元素,X与Y、Q可以原子个数2:1或1:1形成化合物,则X为氢元素,W是第三周期中原子半径最小的主族元素,则W为氯元素,N的核电荷数是W与Z的核电荷数之和,则N为24号元素,铬元素,
(1)由上面的分析可知,X、Z、N、W的元素符号分别为H、N、Cr、Cl,
故答案为:H;N;Cr;Cl;
(2)Y、Z、Q分别为C、N、O,根据元素周期律,同周期从左向右,元素的第一电离能增大,但由于氮元素的最外层p轨道处于半充满状态,所以氮的第一电离能大小要高于相邻主族元素,所以它们的第一电离能大小顺序为N>O>C,
故答案为:N>O>C;
(3)X2Q为H20,常温下呈液态,ZX3为NH3,常温下呈气态,所以水的熔点高于氨气,水和氨气比同主族氢化物的沸点高是因为水和氨气分子间都能形成氢键,
故答案为:H20;NH3;Z和Q的氢化物分子间形成氢键;
(4)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由于非金属性Cl>N,所以HClO4的酸性强于HNO3,
故答案为:HClO4;
(5)N为铬元素,它的价电子排布图为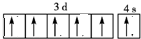 ,故答案为:
,故答案为: ;
;
(6)CrCl3与H20、NH3形成的配位数为6的配合物,其中氨气和水两种配体的个数比为2:1,三个氯离子位于外界,所以配合物的化学式为[Cr(NH3)4(H2O)2]Cl3,
故答案为:[Cr(NH3)4(H2O)2]Cl3.
(1)由上面的分析可知,X、Z、N、W的元素符号分别为H、N、Cr、Cl,
故答案为:H;N;Cr;Cl;
(2)Y、Z、Q分别为C、N、O,根据元素周期律,同周期从左向右,元素的第一电离能增大,但由于氮元素的最外层p轨道处于半充满状态,所以氮的第一电离能大小要高于相邻主族元素,所以它们的第一电离能大小顺序为N>O>C,
故答案为:N>O>C;
(3)X2Q为H20,常温下呈液态,ZX3为NH3,常温下呈气态,所以水的熔点高于氨气,水和氨气比同主族氢化物的沸点高是因为水和氨气分子间都能形成氢键,
故答案为:H20;NH3;Z和Q的氢化物分子间形成氢键;
(4)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由于非金属性Cl>N,所以HClO4的酸性强于HNO3,
故答案为:HClO4;
(5)N为铬元素,它的价电子排布图为
 ,故答案为:
,故答案为: ;
;(6)CrCl3与H20、NH3形成的配位数为6的配合物,其中氨气和水两种配体的个数比为2:1,三个氯离子位于外界,所以配合物的化学式为[Cr(NH3)4(H2O)2]Cl3,
故答案为:[Cr(NH3)4(H2O)2]Cl3.
点评:本题主要考查了元素周期律、物质的性质、配合物等知识点,中等难度,解题注意根据原子结构及元素组成化合物的特点,确定元素种类.

练习册系列答案
相关题目
在以离子键为主的化学键中常含有共价键的成分,下列各对原子形成化学键中共价键成分最少的是( )
| A、Cl,F | B、Na,F |
| C、Na,Cl | D、Mg,O |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、常温常压下,23g的NO2含有的氧原子数为NA |
| B、已知某种元素的一种原子的质量为ag,则该元素的相对原子质量近似为aNA |
| C、某密闭容器盛有0.1molN2和0.4molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D、80gNH4NO3晶体中含有NH4+小于NA个 |
向10mL 1.5mol/L的硫酸铝溶液加入30mL NaOH溶液,充分反应后得到1.56g沉淀,则NaOH溶液的物质的量浓度是( )
| A、1mol/L |
| B、2mol/L |
| C、5mol/L |
| D、3.3mol/L |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、22.4 L O2中含有氧分子的个数为2NA |
| B、24g Mg与足量氧气反应转移的电子数为2NA |
| C、28g N2中含有氮原子的个数为NA |
| D、1L 1 mol?L-1MgCl2溶液中含有氯离子个数为NA |