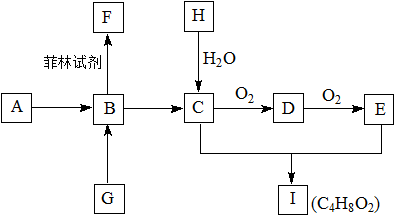
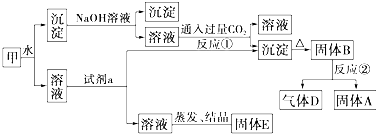
题目内容
下列每组反应一定能用同一离子方程式表示的是( )
| A、CaCO3、Na2CO3分别与盐酸反应 |
| B、CuO分别与稀硫酸、稀盐酸、稀硝酸反应 |
| C、H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 |
| D、Na分别与水、稀盐酸反应 |
考点:离子方程式的书写
专题:
分析:A.碳酸钙为沉淀保留化学式,碳酸钠应拆成离子形式;
B.CuO分别与稀硫酸、稀盐酸、稀硝酸反应实质都是,氧化铜与氢离子反应生成铜离子和水;
C.K2SO4溶液与Ba(OH)2溶液实质是硫酸根离子与钡离子反应,H2SO4溶液与Ba(OH)2溶液实质除了硫酸根离子与钡离子反应,氢离子与氢氧根离子也发生反应;
D.水为弱电解质应保留化学式,氯化氢为强电解质拆成离子形式.
B.CuO分别与稀硫酸、稀盐酸、稀硝酸反应实质都是,氧化铜与氢离子反应生成铜离子和水;
C.K2SO4溶液与Ba(OH)2溶液实质是硫酸根离子与钡离子反应,H2SO4溶液与Ba(OH)2溶液实质除了硫酸根离子与钡离子反应,氢离子与氢氧根离子也发生反应;
D.水为弱电解质应保留化学式,氯化氢为强电解质拆成离子形式.
解答:
解:A.CaCO3、Na2CO3分别与盐酸反应,前者保留化学式,二者不能用同一个离子方程式表示,故A错误;
B.CuO分别与稀硫酸、稀盐酸、稀硝酸反应实质都是,氧化铜与氢离子反应生成铜离子和水,离子方程式都是:CuO+2H+=H2O+Cu2+,故B正确;
C.K2SO4溶液与Ba(OH)2溶液实质是硫酸根离子与钡离子反应,H2SO4溶液与Ba(OH)2溶液实质除了硫酸根离子与钡离子反应,氢离子与氢氧根离子也发生反应,二者反应的实质不一样,不能用同一个离子方程式表示,故C错误;
D.水为弱电解质应保留化学式,氯化氢为强电解质拆成离子形式,二者不能用同一个离子方程式表示,故D错误;
故选:B.
B.CuO分别与稀硫酸、稀盐酸、稀硝酸反应实质都是,氧化铜与氢离子反应生成铜离子和水,离子方程式都是:CuO+2H+=H2O+Cu2+,故B正确;
C.K2SO4溶液与Ba(OH)2溶液实质是硫酸根离子与钡离子反应,H2SO4溶液与Ba(OH)2溶液实质除了硫酸根离子与钡离子反应,氢离子与氢氧根离子也发生反应,二者反应的实质不一样,不能用同一个离子方程式表示,故C错误;
D.水为弱电解质应保留化学式,氯化氢为强电解质拆成离子形式,二者不能用同一个离子方程式表示,故D错误;
故选:B.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应为解答的关键,注意离子反应的书写方法、离子反应中需保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、常温常压下,23g的NO2含有的氧原子数为NA |
| B、已知某种元素的一种原子的质量为ag,则该元素的相对原子质量近似为aNA |
| C、某密闭容器盛有0.1molN2和0.4molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D、80gNH4NO3晶体中含有NH4+小于NA个 |
向10mL 1.5mol/L的硫酸铝溶液加入30mL NaOH溶液,充分反应后得到1.56g沉淀,则NaOH溶液的物质的量浓度是( )
| A、1mol/L |
| B、2mol/L |
| C、5mol/L |
| D、3.3mol/L |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、22.4 L O2中含有氧分子的个数为2NA |
| B、24g Mg与足量氧气反应转移的电子数为2NA |
| C、28g N2中含有氮原子的个数为NA |
| D、1L 1 mol?L-1MgCl2溶液中含有氯离子个数为NA |
下列化学反应的离子方程式正确的是( )
| A、往明矾溶液中逐滴加入氢氧化钡溶液至SO42-恰好完全沉淀Al3++2 SO42-+2 Ba2++4 OH-=2 BaSO4↓+AlO2-+2 H2O |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C、用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| D、AgNO3溶液中加入过量的氨水:Ag++NH3?H2O=AgOH↓+NH4+ |
下列粒子的结构示意图中,表示氯离子的是( )
A、 |
B、 |
C、 |
D、 |