题目内容
9.反应3H2+N2?2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
分析 A.升高温度能加快反应速率的主要原因是活化分子的百分数增加;
B.催化剂降低反应的活化能,能加快反应速率;
C.将氨气液化排出,生成物浓度减小,反应速率减小;
D.反应是可逆反应不能减小彻底;
解答 解:A.升高温度,分子能量增加,增加了活化分子的百分数,增加有效碰撞的次数,反应速率增大,故A正确;
B.加入催化剂降低反应的活化能能增大反应速率,故B正确;
C.将氨气液化排出,生成物浓度减小,反应速率减小,正逆反应速率减小,故C错误;
D.反应3H2+N2?2NH3在密闭容器中进行是可逆反应,不能进行彻底,N2与H2不能完全转化为NH3 ,故D正确;
故选C.
点评 本题考查化学反应速率的影响因素,题目较为基础,注意可逆反应的特点.

练习册系列答案
相关题目
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、HCO3-、NO3- | |
| C. | pH=1的无色溶液中:K+、Fe3+、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- |
1.(1)用天平称取40.0g NaOH配制500mL 2.0mol•L-1的溶液时,除了烧杯、玻璃棒外,还要使用的玻璃仪器是胶头滴管、500容量瓶.
(2)现有一瓶A和B的混合液,已知它们的性质如下表.
据此分析,将A和B相互分离的常用方法是蒸馏.
(2)现有一瓶A和B的混合液,已知它们的性质如下表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
18.某同学按下述操作配制100 mL 0.20 mol•L-1Na2SO4溶液,请回答有关问题.
(2)取出该Na2SO4溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.04mol/L.
(3)在实验中,以下操作对实验结果没有影响的是C.
A.没有将洗涤液转移到容量瓶中 B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为3.0g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | \ |
| ⑥摇匀、装瓶、贴上标签 | \ |
(3)在实验中,以下操作对实验结果没有影响的是C.
A.没有将洗涤液转移到容量瓶中 B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.
19.下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法:
| 物质 | 杂质 | 除杂试剂或方法 |
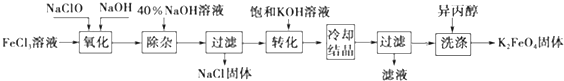
| (1)FeCl3溶液 | FeCl2 | |
| (2)FeCl2溶液 | FeCl3 | |
| (3)FeSO4溶液 | CuSO4 | |
| (4)Na2CO3 | NaHCO3 | |
| (5)Mg (OH)2 | Al(OH)3 | , |
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);