题目内容
18.某同学按下述操作配制100 mL 0.20 mol•L-1Na2SO4溶液,请回答有关问题.| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为3.0g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | \ |
| ⑥摇匀、装瓶、贴上标签 | \ |
(3)在实验中,以下操作对实验结果没有影响的是C.
A.没有将洗涤液转移到容量瓶中 B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.
分析 (1)①依据m=CVM计算需要溶质的质量;
②依据配制溶液的体积选择合适的容量瓶;
(2)依据稀释过程中溶质的物质的量不变计算稀释后硫酸钠的物质的量浓度,硫酸钠溶液C(Na+)=2(Na2SO4)
;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)硫酸根与钡离子能生成难溶于水和难溶于酸的沉淀,据此分析解答.
解答 解:①配制100 mL 0.20 mol•L-1Na2SO4溶液,需要溶质的质量m=0.20mol/L×0.1L×142g/mol≈3.0g;
②配制100 mL 0.20 mol•L-1Na2SO4溶液,应选择100mL容量瓶;
故答案为:3.0 ②100mL容量瓶;
(2)设稀释后硫酸钠的物质的量浓度为C,则依据稀释过程中溶质的物质的量不变得:0.20 mol•L-1×10mL=100mL×C,解得C=0.02mol/L,C(Na+)=2(Na2SO4)=0.04mol/L;
故答案为:0.04mol/L;
(3)A.没有将洗涤液转移到容量瓶中,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
B.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
C.转移前没有将使用的容量瓶烘干,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故选;
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:C;
(4)硫酸根与钡离子能生成难溶于水和难溶于酸的沉淀,注意排除碳酸根离子、亚硫酸根离子、银离子的干扰,所以正确的操作方法为:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀;
故答案为:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀;
点评 本题考查了一定物质的量浓度溶液的配制,硫酸根离子的检验,明确配制原理和操作步骤是解题关键,注意离子检验实验设计的严密性,题目难度不大.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | 亚硫酸钠 | B. | 过氧化钠 | C. | 硫酸亚铁 | D. | 氢硫酸 |
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池负极的反应式为:Pb-2e -→Pb2+ | |
| B. | 铅蓄电池放电时,该电池两极质量均减少 | |
| C. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| D. | 电解苦卤水时,a电极首先放电的是Br- |
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
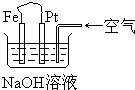
| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
| A. | 为防止试管破裂,加热固体碳酸氢钠时,试管口应略向下倾斜 | |
| B. | 为防止液体暴沸,蒸馏时可在烧瓶中加入少量碎瓷片 | |
| C. | 容量瓶可用于配制一定物质的量浓度的溶液,不可作为反应容器使用 | |
| D. | 配制500mL 0.1 mol/L NaOH溶液时,将2g NaOH固体倒入500mL容量瓶中,加水至凹液面与刻度线相切 |
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |

 ,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变红棕色.