题目内容
4. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.
分析 (1)化平衡常数K值越大,表示可逆反应正向进行程度越大;温度升高,若平衡正向移动,平衡常数增大,若平衡逆向移动,平衡常数减小;
(2)由图可知,0~4min内△c(CO)=(0.2-0.08)mol/L=0.12mol/L,根据v=$\frac{△c}{△t}$计算v(CO).
解答 解:(1)化平衡常数K值越大,表示可逆反应正向进行程度越大;温度升高,若平衡正向移动,平衡常数增大,若平衡逆向移动,平衡常数减小,故升高温度平衡常数可能增大也可能减小,
故答案为:越大;可能增大也可能减小;
(2)由图可知,0~4min内△c(CO)=(0.2-0.08)mol/L=0.12mol/L,故v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol/(L.min),
故答案为:0.03.
点评 本题考查化学平衡常数及有关计算、反应速率计算等,难度不大,侧重对基础知识的巩固.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
4.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速度,其中反应进行得最快的是( )
| A. | v(A)=0.01mol•L-1•s-1 | B. | v(B)=0.02mol•L-1•s-1 | ||
| C. | v(B)=0.60mol•L-1•min-1 | D. | v(C)=1.00mol•L-1•min-1 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 22.4L的Cl2与足量Fe反应,转移的电子数为3NA | |
| C. | 50mL 18mol•L-1浓硫酸与足量Cu共热,转移的电子数为0.9MA | |
| D. | 高温下,0.3molFe与足量水蒸气反应,生成H2的分子数为0.3NA |
2.某同学拟设计如下流程测定铜银合金中铜的质量分数:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
9.反应3H2+N2?2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
16.下列有关说法正确的是( )
| A. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | 镀锌铁镀层破损后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法 |
13. 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池负极的反应式为:Pb-2e -→Pb2+ | |
| B. | 铅蓄电池放电时,该电池两极质量均减少 | |
| C. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| D. | 电解苦卤水时,a电极首先放电的是Br- |


 .请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH
.请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH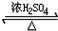 CH3COOCH2CH2CH3+H2O
CH3COOCH2CH2CH3+H2O