题目内容
1.(1)用天平称取40.0g NaOH配制500mL 2.0mol•L-1的溶液时,除了烧杯、玻璃棒外,还要使用的玻璃仪器是胶头滴管、500容量瓶.(2)现有一瓶A和B的混合液,已知它们的性质如下表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
分析 (1)依据m=CVM计算配制500mL 2.0mol•L-1的氢氧化钠溶液需要溶质的质量,依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)两种液体互溶且沸点相差比较大应选择蒸馏方法将二者分离.
解答 解:(1)配制500mL 2.0mol•L-1的氢氧化钠溶液需要溶质的质量m=2.0mol/L×0.5L×40g/mol=40.0g;
配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、移液、洗涤、定容,用到的仪器:500mL容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平、药匙,所以还要使用的玻璃仪器:胶头滴管、500容量瓶;
故答案为:胶头滴管、500容量瓶;
(2)由表中信息可知二者互溶,且沸点相差比较大应选择蒸馏方法将二者分离;
故答案为:蒸馏.
点评 本题考查了一定物质的量浓度溶液的配制,物质分离方法的选择,明确溶液配制原理及过程、熟悉常用物质分离方法是解题关键,注意蒸馏与蒸发的区别,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.某同学拟设计如下流程测定铜银合金中铜的质量分数:
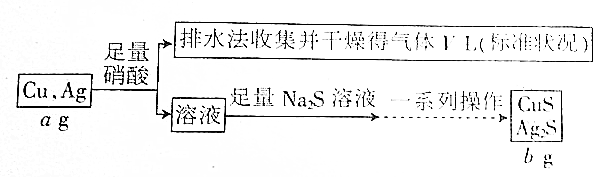
下列说法不正确的是( )

下列说法不正确的是( )
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
9.反应3H2+N2?2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
16.下列有关说法正确的是( )
| A. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | 镀锌铁镀层破损后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法 |
13. 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池负极的反应式为:Pb-2e -→Pb2+ | |
| B. | 铅蓄电池放电时,该电池两极质量均减少 | |
| C. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| D. | 电解苦卤水时,a电极首先放电的是Br- |
10.对于如图装置,下列说法正确的是( )
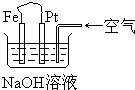

| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
11.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c (OH-)=1×10-14 mol•L-1溶液:K+ Na+ Cl- HCO3- |
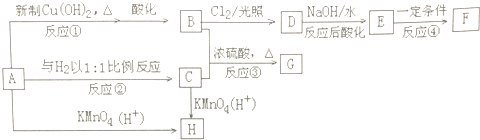
 ,H
,H .
. ;
; .
.
 、
、 .
. )是一种化工产品.请结合题目中有关信息,设计以苯乙烯(
)是一种化工产品.请结合题目中有关信息,设计以苯乙烯(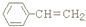 )为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).
)为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).
 ,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变红棕色.