题目内容
10.海水中有非常丰富的化学资源,从海水中可提取多种化工原料.某工厂对海水资源综合开发利用的部分工艺流程图如下.回答下列问题:
(1)化学实验中常用到与海水晒盐原理相同的操作名称是蒸发结晶,必需的仪器有铁架台(含铁圈)、蒸发皿、玻璃棒、酒精灯.
(2)精制食盐水时下列物质中,不必用到的有③⑤⑦.
①NaOH溶液②盐酸③K2CO3溶液④BaCl2溶液⑤硫酸⑥Na2CO3溶液⑦Ba(NO3)2溶液
(3)下列说法错误的是D
A.海水中的镁、溴、碘元素都处于化合态
B.步骤②④中通入Cl2能制得单质溴,因为Cl2的氧化性比Br2强
C.步骤③中鼓入热空气分离出Br2,利用了Br2的挥发性
D.步骤⑤发生反应的离子方程式为:Mg2++2OH-═Mg(OH)2↓
(4)步骤②中已获得Br2,步骤③中又将Br2还原为Br,其目的为富集溴元素.
(5)步骤③反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-;该步骤也可以采用纯碱吸收,反应方程式:3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3,当转移3.01×1023个电子时,吸收Br2的物质的量为0.3mol.
(6)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤.加入MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤.
分析 海水通过晒盐得到粗盐,精制后电解饱和食盐水是氯碱工业,制备氯气、烧碱;得到苦卤中主要是含有氯化镁,苦卤中加入氯气氧化溴离子得到溴单质,通过萃取分液方法得到低浓度的溴单质,通入热空气吹出溴单质,用二氧化硫水溶液吸收得到含HBr的溶液再通入氯气氧化溴离子为溴单质富集溴元素,得到溶液中加入氢氧化钙沉淀分离出氢氧化镁沉淀,氢氧化镁用盐酸溶解得到氯化镁溶液,蒸发浓缩冷却结晶得到氯化镁晶体,电解熔融氯化镁得到镁,
(1)海水晒盐原理是利用氯化钠溶解度随温度变化不大,可以蒸发结晶的方法得到溶质,蒸发结晶是用酒精灯加热蒸发皿中的溶液得到溶质晶体;
(2)可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,用盐酸除掉过量的CO32-、OH-,以此分析;
(3)A.镁、溴、碘性质活泼;
B.因为Cl2的氧化性比Br2强,Cl2+2Br-=Br2+2Cl-;
C.利用了Br2的挥发性得到溴蒸气;
D.步骤⑤发生反应是加入石灰乳不能拆成离子
(4)溴和二氧化硫发生反应Br2+SO2+2H2O=2HBr+H2SO4,再向含有HBr的溶液中通入适量氯气蒸馏得到溴单质,可起到富集溴元素的目的;
(5)步骤③反应是溴单质和二氧化硫反应生成硫酸和溴化氢,3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3,反应中电子转移5mol,吸收Br2的物质的量为3mol,当转移3.01×1023个电子时物质的量=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,计算吸收Br2的物质的量;
(6)溶度积常数大的物质向溶度积常数小的物质转化,氢氧化钙的溶度积常数大于氢氧化镁,所以加入氯化镁溶液,充分搅拌,过滤,沉淀用水洗涤得到氢氧化镁固体.
解答 解:(1)海水晒盐原理是利用氯化钠溶解度随温度变化不大,可以蒸发结晶的方法得到溶质,必需的仪器有铁架台(含铁圈)、蒸发皿,玻璃棒,酒精灯,
故答案为:蒸发结晶;蒸发皿;玻璃棒;酒精灯;
(2)精制食盐水时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,用盐酸除掉过量的CO32-、OH-,
因此用到的有①②④⑥,其他③⑤⑦的都用不到,
故答案为:③⑤⑦;
(3)A.镁、溴、碘性质活泼,海水中的镁、溴、碘元素都处于化合态,故A正确;
B.步骤②④中通入Cl2能制得单质溴,因为Cl2的氧化性比Br2强,Cl2+2Br-=Br2+2Cl-,故B正确;
C.步骤③中鼓入热空气分离出Br2,利用了Br2的挥发性得到溴蒸气,故C正确;
D.步骤⑤发生反应是加入石灰乳不能拆成离子,反应的离子方程式为:Mg2++Ca(OH)2═Mg(OH)2↓+Ca2+,故D错误;
故答案为:D;
(4)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,步骤I中获取的溴浓度较小,所以其目的是富集溴元素,故答案为:富集溴元素;
(5)步骤③反应是溴单质和二氧化硫反应生成硫酸和溴化氢,Br2+SO2+2H2O=4H++2Br-+SO42-,步骤③反应是溴单质和二氧化硫反应生成硫酸和溴化氢,3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3,反应中电子转移5mol,吸收Br2的物质的量为3mol,当转移3.01×1023个电子时物质的量=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,计算吸收Br2的物质的量0.3mol,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-; 0.3mol;
(6)溶度积常数大的物质向溶度积常数小的物质转化,氢氧化钙的溶度积常数大于氢氧化镁,所以加入氯化镁溶液,充分搅拌,过滤,沉淀用水洗涤得到氢氧化镁固体,故答案为:加入MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤.
点评 本题考查物质的分离提纯,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,注意把握实验的原理和操作方法,难度中等.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | NaClO | B. | Cl2 | C. | NaOH | D. | NaCl |
| A. | 亚硫酸钠 | B. | 过氧化钠 | C. | 硫酸亚铁 | D. | 氢硫酸 |
| A. | 46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 22.4L的Cl2与足量Fe反应,转移的电子数为3NA | |
| C. | 50mL 18mol•L-1浓硫酸与足量Cu共热,转移的电子数为0.9MA | |
| D. | 高温下,0.3molFe与足量水蒸气反应,生成H2的分子数为0.3NA |

下列说法不正确的是( )
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
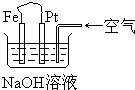
| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |

 ,H
,H .
. ;
; .
.
 、
、 .
. )是一种化工产品.请结合题目中有关信息,设计以苯乙烯(
)是一种化工产品.请结合题目中有关信息,设计以苯乙烯( )为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).
)为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).