题目内容
17.在某温度下,pH相同的CH3COOH溶液(浓度为cmol/L)和NH4Cl溶液,溶液中水电离出的c(H+)分别是10-amol/L和10-bmol/L.在该条件下,下列说法正确的是( )| A. | 两溶液中水的电离程度相同 | B. | 水的离子积常数为1.0×10-(a+b) | ||
| C. | CH3COOH的电离常数为$\frac{(1{0}^{-2a})}{c}$ | D. | 两溶液中c(CH3COO-)=c(NH4+) |
分析 A.酸抑制水的电离,能水解的盐促进水的电离;
B.水的离子积常数=c(H+)×c(OH-);
C.根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$计算;
D.pH相同,即氢离子浓度相同,则氢氧根离子浓度相同,结合电荷守恒分析.
解答 解:A.酸抑制水的电离,所以CH3COOH溶液中水的电离平衡向逆方向移动,能水解的盐促进水的电离,则NH4Cl溶液中水的电离平衡向正方向移动,所以两溶液中水的电离程度不相同,故A错误;
B.NH4Cl溶液中氢离子全部由水电离,其浓度为10-bmol/L,pH相同,即氢离子浓度相同,则CH3COOH溶液中氢离子浓度为10-bmol/L,醋酸中水电离的氢离子浓度等于水电离的氢氧根离子的浓度,则醋酸中氢氧根离子的浓度为10-amol/L,故水的离子积常数=c(H+)×c(OH-)=10-a×10-b=1.0×10-(a+b),故B正确;
C.由B分析可知,CH3COOH溶液中氢离子浓度为10-bmol/L,则醋酸根离子的浓度为10-bmol/L,则Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-b}×1{0}^{-b}}{c-1{0}^{-b}}$≈$\frac{1{0}^{-2b}}{c}$,故C错误;
D.pH相同,即氢离子浓度相同,则氢氧根离子浓度相同,醋酸中的电荷守恒为:c(CH3COO-)+c(OH-)=c(H+),NH4Cl溶液中电荷守恒为c(Cl-)+c(OH-)=c(H+)+c(NH4+),所以c(CH3COO-)+c(OH-)=c(Cl-)+c(OH-)-c(NH4+),则c(CH3COO-)+c(NH4+)=c(Cl-),故D错误.
故选B.
点评 本题考查了弱电解质的电离、水的离子积常数的计算、电离常数的计算等、影响水的电离平衡的因素等,题目难度中等,注意把握电离常数的计算方法以及溶液中水电离的氢离子或氢氧根离子浓度的计算方法.

| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| D. | Na2O2晶体中既含有离子键又含有共价键 |
| A. | 含最高价元素的化合物,一定具有强氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子多的还原剂,还原性就强 | |
| D. | 化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原 |
| A. | ④>③>②>① | B. | ④>③>①>② | C. | ④>②>①>③ | D. | ④>②>③>① |
| A. | 使用SO2漂白过的物品在使用过程中会慢慢恢复为漂白前的颜色 | |
| B. | 向含有纯碱的废水中加入适量生石灰,可以消除水中的污染 | |
| C. | 大量焚烧田间秸秆会促进雾霾的形成 | |
| D. | 用热碱水吸收有利于除去手上的油脂形成的污渍 |
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- |
| A. | Na2C2O4溶液呈碱性:C2O42-+2H2O═H2C2O4+2OH- | |
| B. | AgOH溶解在氨水里:AgOH+2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 钢铁发生电化腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 淀粉KI试纸经硫酸酸化后在空气中变蓝:4I-+O2+2H2O═2I2+4OH- |
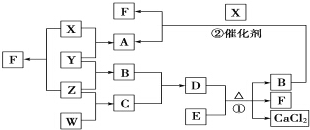 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.