题目内容
9.下列表示对应化学反应的离子方程式中,正确的是( )| A. | Na2C2O4溶液呈碱性:C2O42-+2H2O═H2C2O4+2OH- | |
| B. | AgOH溶解在氨水里:AgOH+2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 钢铁发生电化腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 淀粉KI试纸经硫酸酸化后在空气中变蓝:4I-+O2+2H2O═2I2+4OH- |
分析 A.草酸根离子为多元弱酸根离子,分步水解,以第一步为主;
B.氢氧化银与氨水发生络合反应,生成可溶性络合物;
C.铁失去电子生成二价铁离子;
D.不符合反应客观事实.
解答 解:A.Na2C2O4溶液呈碱性,离子方程式:C2O42-+2H2O?HC2O4-+OH-,故A错误;
B.AgOH溶解在氨水里,离子方程式:AgOH+2NH3•H2O═[Ag(NH3)2]++2H2O,故B正确;
C.钢铁发生电化腐蚀的负极反应,离子方程式:Fe-2e-═Fe2+,故C错误;
D.粉KI试纸经硫酸酸化后在空气中变蓝,反应生成碘和水,离子方程式:4I-+O2+4H+═2I2+2H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意多元弱酸的酸式根离子分步水解,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.在某温度下,pH相同的CH3COOH溶液(浓度为cmol/L)和NH4Cl溶液,溶液中水电离出的c(H+)分别是10-amol/L和10-bmol/L.在该条件下,下列说法正确的是( )
| A. | 两溶液中水的电离程度相同 | B. | 水的离子积常数为1.0×10-(a+b) | ||
| C. | CH3COOH的电离常数为$\frac{(1{0}^{-2a})}{c}$ | D. | 两溶液中c(CH3COO-)=c(NH4+) |
20. (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
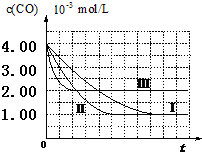
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D.
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D.
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
17.下列状态的物质,既能导电又属于电解质的是( )
| A. | 熔融的NaOH | B. | 液态HCl | C. | KCl溶液 | D. | 蔗糖溶液 |
4.下列离子反应方程式正确的是( )
| A. | 碳酸氢钠溶液跟过量的饱和石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液显中性H++SO42-+-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气 Fe2++Cl2═Fe3++2Cl- | |
| D. | 苛性钾溶液中加入稀盐酸 H++OH-═H2O |
1.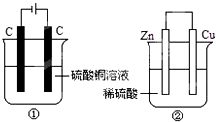 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阳极:4OH --4e -═2H2O+O2↑ ②中负极:2H ++2e -═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |


 .
.