题目内容
12.X、Y两元素的原子,它们分别获得一个电子后,都能形成稀有气体原子的电子层结构,此过程中X放出的能量大于Y,下列推断中不正确的是( )| A. | X的还原性大于Y | B. | X-的还原性大于Y- | ||
| C. | Y的氧化性小于X | D. | Y的氧化性大于X |
分析 根据非金属元素的原子获得相同数目的电子放出热量越多,生成的阴离子越稳定,原子的非金属性越强,氧化性越强来分析.
解答 解:非金属元素的原子获得相同数目的电子放出热量越多,生成的阴离子越稳定,原子的非金属性越强,由此可知:X的非金属性比Y的强,氧化性X>Y,还原性X<Y,其还原性Y->X-.
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,本题注意从能量的角度分析元素的非金属性的方法.注意元素周期律的递变规律.

练习册系列答案
相关题目
3.下列实验中不需要使用温度计的是( )
| A. | 溴乙烷的水解 | B. | 苯的硝化反应 | C. | 石油的分馏 | D. | 由乙醇制乙烯 |
20.工业上获得乙烯和丙烯的方法是( )
| A. | 石油分馏 | B. | 煤的干馏 | C. | 石蜡催化裂化 | D. | 重油裂解 |
7.下表给出14~17号元素的一些性质,请回答:
(1)它们所形成的氢化物中稳定性最差的是SiH4,还原性最差的是HCl.(写化学式)
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强(增强或减弱)
(3)写出下列物质电子式K2SK+ K+ PCl3
K+ PCl3 .
.
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强(增强或减弱)
(3)写出下列物质电子式K2SK+
 K+ PCl3
K+ PCl3 .
.
17.下列说法正确的是( )
| A. | K的原子结构示意图 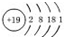 | B. | CO2的结构式 O-C-O | ||
| C. | C-12原子的表示方法:C612 | D. | NH4Cl的电子式: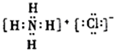 |
1.某烷烃含有100个氢原子,那么该烃的分子式是( )
| A. | C47H100 | B. | C48H100 | C. | C49H100 | D. | C50H100 |
2.25℃时,pH=2某酸(HA)与pH=12某碱(BOH)等体积混合后,混合液的pH=10,下列描述中正确的是( )
| A. | 若两者中有一种为强电解质,则一定是BOH | |
| B. | 若HA是强酸,混合液中离子浓度关系一定是C(A-)>C(B+)>C(HO-)>C(H+) | |
| C. | 若混合液中存在离子水解,则一定是A-水解 | |
| D. | 两者混合后,BOH有可能过量 |
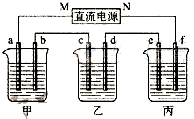 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极. Na2O2
Na2O2 OH-
OH- N2H4
N2H4 .
.