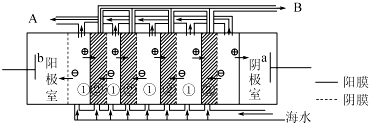
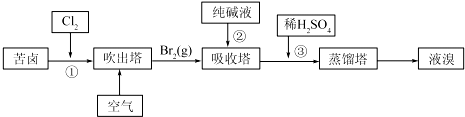
题目内容
4.写出下列物质的电子式H2O
 Na2O2
Na2O2 OH-
OH- N2H4
N2H4 .
.
分析 首先判断化合物是离子化合物还是共价化合物;
若是离子化合物,其电子式 由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答 解:H2O是共价化合物,氧原子分别与两个氢原子通过一对共用电子对结合,H2O电子式为 ;Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为
;Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为 ; OH-电子式为:
; OH-电子式为: ;肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,电子式为
;肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,电子式为
故答案为: ;
; ;
; ;
;
点评 本题考查化学键的类型以及电子式的书写,题目难度不大,注意离子键与共价键的区别以及电子式的书写方法,原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
14.上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(简称甲醚)为燃料的公交车作为“绿色”花园中的一点鲜艳的绿色已经正式“登台”.下列叙述正确的是( )
| A. | 甲醚作燃料会产生氮的氧化物和碳氢化合物等污染物 | |
| B. | 甲醚可由甲醇在一定条件下发生消去反应而制得 | |
| C. | 甲醚与乙醇是同分异构体 | |
| D. | 1 mol甲醚完全燃烧消耗的氧气与1 mol甲醇完全燃烧消耗的氧气相同 |
15.下列说法正确的是( )
| A. | 阴阳离子间通过静电吸引形成的化学键叫做离子键 | |
| B. | HF,HCl,HBr,HI的热稳定性和酸性均依次减弱 | |
| C. | 元素非金属越强,其对应含氧酸的酸性就越强 | |
| D. | 元素周期律是元素原子核电子排布周期性变化的结果 |
12.X、Y两元素的原子,它们分别获得一个电子后,都能形成稀有气体原子的电子层结构,此过程中X放出的能量大于Y,下列推断中不正确的是( )
| A. | X的还原性大于Y | B. | X-的还原性大于Y- | ||
| C. | Y的氧化性小于X | D. | Y的氧化性大于X |
19.鉴别Cl-、Br-、I-可以选用的试剂是( )
| A. | 碘水,淀粉溶液 | B. | 溴水,四氯化碳 | ||
| C. | 淀粉,KI溶液 | D. | 硝酸银溶液,稀HNO3 |
16.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 | |
| B. | X、Y、Z组成的一种离子化合物,其中X、Y、Z元素原子个数比可能为4:2:3 | |
| C. | X和Z可以形成X2Z和X2Z2型化合物,所含共价键类型不完全相同 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种 |
13.化学反应中旧键断裂需要( )能量.
| A. | 吸收 | B. | 放出 | C. | 不吸收也不放出 | D. | 不一定 |
14.下列说法错误的是( )
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 |