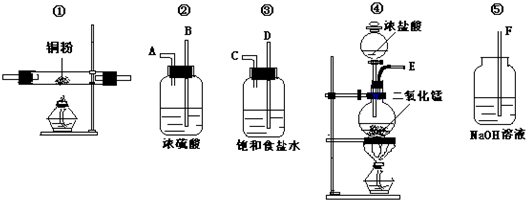
题目内容
2.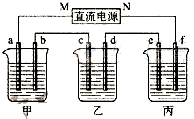 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极.(1)接通电源,经过一段时间后,测得丙中KNO3浓度为10.47%,乙中d电极质量增加.据此回答问题:
①电源的M端为正极;②电极a上发生的电极反应为4OH--4e-=2H2O+O2↑;
③电极b上生成的气体在标准状况下的体积为5.6L:
④电极d的质量变化是32 g;
⑤电解前后甲溶液的酸、碱性发生变化,简述其原因:因为电解后,溶液中生成NaOH,使溶液碱性增强;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应.
分析 (1)接通电源,经过一段时间后,乙中d电极质量增加,所以d电极是阴极,据此判断各个电极名称以及电源的电极名称,根据电极名称结合电解池的工作原理书写电极反应,并根据电子守恒进行相应的计算;
(2)如果电解过程中铜全部析出,此时的电解质称为硫酸溶液,根据电解池的构成条件,电解池可以构成,据此回答.
解答 解:(1)①接通电源,经过一段时间后,乙中d电极质量增加,所以d电极是阴极,c是阳极,e是阳极,f是阴极,N是负极,M是正极,故答案为:正;
②M是正极,a是阳极,根据放电顺序,电极a上发生的电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
③丙中200g10.00%的KNO3溶液,在电解后,KNO3浓度为10.47%,设电解掉的水的质量是m,则:200g×10.00%=(200-m)×10.47%,解得m≈9g,减少9g水转移电子的物质的量=$\frac{9g}{18g/mol}$×2=1mol;当转移1mol电子时,b上生成的气体体积=$\frac{1mol}{4}$×22.4L/mol=5.6L;故答案为:5.6L;
④电极d是阴极,增加Cu的质量=$\frac{1mol}{2}$×64g/mol=32g.故答案为:32;
⑤电解氯化钠溶液,生成的溶液时氢氧化钠溶液,同时放出氢气和氯气,使溶液碱性增强,故答案为:因为电解后,溶液中生成NaOH,使溶液碱性增强;
(2)如果电解过程中铜全部析出,此时的电解质称为硫酸溶液,根据电解池的构成条件,电解池可以构成,反应也就变为水的电解反应,故答案为:能继续进行;因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应.
点评 本题考查了原电池、电解池工作原理以及物质的量的有关计算,根据转移电子数相等来分析解答即可,难度不大.

| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 医疗上使用75%的酒精用于消毒 | |
| D. | 糖类、油脂、蛋白质在一定条件下都可发生水解反应 |
| A. | 用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH | |
| B. | 向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 | |
| C. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 | |
| D. | 取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
| A. | 甲醚作燃料会产生氮的氧化物和碳氢化合物等污染物 | |
| B. | 甲醚可由甲醇在一定条件下发生消去反应而制得 | |
| C. | 甲醚与乙醇是同分异构体 | |
| D. | 1 mol甲醚完全燃烧消耗的氧气与1 mol甲醇完全燃烧消耗的氧气相同 |
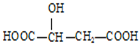 ,下列说法正确的是( )
,下列说法正确的是( )| A. | HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 | |
| B. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| C. | 1mol苹果酸与足量金属Na反应生成生成1mol H2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
| A. | X的还原性大于Y | B. | X-的还原性大于Y- | ||
| C. | Y的氧化性小于X | D. | Y的氧化性大于X |
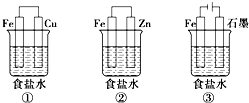 铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.