题目内容
9.燃料电池是目前正在探索的一种新型电池.它主要是利用燃料在燃烧过程中把化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是:x极 O2+2H2O+4e-=4OH-
y极 H2+2OH-=2H2O+2e-
回答下列问题:
(1)x是正极(填“正”或“负”),发生还原反应(填“氧化”或“还原”)
(2)y是负极(填“正”或“负”),发生氧化反应(填“氧化”或“还原”),
(3)总反应式为2H2+O2=2H2O.
分析 在燃料电池的正极上是氧气得电子的还原反应;在原电池的负极上是燃料失电子的氧化反应,两极方程式相加得到总反应式.
解答 解:(1)在燃料电池的正极上是氧气得电子的还原反应,所以x是正极,故答案为:正;还原;
(2)在原电池的负极上是燃料失电子的氧化反应,所以y是负极,故答案为:负;氧化;
(3)两极相加得到总反应是2H2+O2=2H2O,故答案为:2H2+O2=2H2O.
点评 本题考查电极反应的判断,为高频考点,题目难度不大,解答本题可从化合价的变化的角度入手,把握电极反应.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目
20.下列溶液中,Na+物质的量浓度最大的是( )
| A. | 10 mL 0.4 mo l•L-1 NaOH溶液 | B. | 5 mL 0.3 mo l•L-1 Na3PO4溶液 | ||
| C. | 10 mL 0.3 mo l•L-1 Na2SO4溶液 | D. | 5 mL 0.5 mol•L-1 NaNO3溶液 |
14.下列物质不能用加成反应得到的是( )
| A. | CH2Cl2 | B. | CH3CH2Cl | C. | CH3CH2OH | D. |  |
1.下列关于SiO2和CO2 的叙述中正确的是( )
| A. | 两者都是酸性氧化物,故均不与酸反应 | |
| B. | 两者都可以与NaOH溶液反应 | |
| C. | CO2 的溶沸点比SiO2高 | |
| D. | 两者都能与水反应生成对应的酸且碳酸的酸性大于硅酸 |
18.用化学方法除去下列物质中的杂质(括号内为杂质),填写所加试剂和有关离子反应方程式.
| 试剂 | 离子反应方程式 | |
| ①Mg(Al) | ||
| ②FeCl2溶液(FeCl3) | ||
| ③NaHCO3(Na2CO3) |
19.下列微粒中,电子层结构完全相同的一组是( )
| A. | S2-、Cl-、K+ | B. | Cl-、Br-、I- | C. | Na+、Mg2+、Cl- | D. | O2-、Mg2+、Cl- |
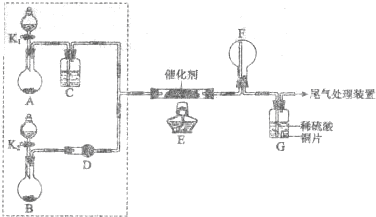

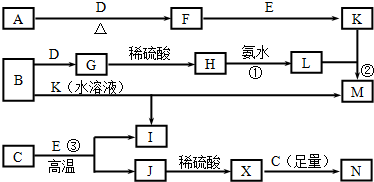
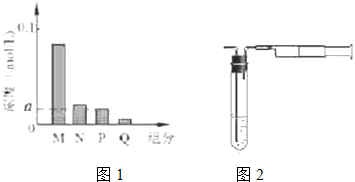 已知X、Y是两种性质相似的短周期元素.
已知X、Y是两种性质相似的短周期元素. ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族. ,X是形成化合物种类最多的元素.
,X是形成化合物种类最多的元素. ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.