题目内容
1.下列关于SiO2和CO2 的叙述中正确的是( )| A. | 两者都是酸性氧化物,故均不与酸反应 | |
| B. | 两者都可以与NaOH溶液反应 | |
| C. | CO2 的溶沸点比SiO2高 | |
| D. | 两者都能与水反应生成对应的酸且碳酸的酸性大于硅酸 |
分析 A.二氧化硅能与氢氟酸反应;
B.SiO2和CO2都是酸性氧化物,具有酸性氧化物的通性;
C.二氧化硅是原子晶体;
D.二氧化硅不能与水反应.
解答 解:A.二氧化硅能与氢氟酸反应生成四氟化硅气体,故A错误;
B.SiO2和CO2都是酸性氧化物,都能与NaOH溶液反应,故B正确;
C.二氧化碳是分子晶体,二氧化硅是原子晶体,原子晶体的熔沸点高,故C错误;
D.二氧化硅不溶于水,不能与水反应,故D错误.
故选B.
点评 本题考查硅及其化合物的性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
相关题目
6.已知:A~F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+的M层3d轨道电子为半充满状态.请根据以上信息,回答下列问题:
(1)A、B、C的电负性由小到大的顺序为C<O<N(用元素符号表示).
(2)D元素的原子核外共有12种不同运动状态的电子、4种不同能级的电子.
(3)写出E的基态原子的电子排布式:1s22s22p63s23p64s2.
(4)F和X(质子数为25)两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态.
(1)A、B、C的电负性由小到大的顺序为C<O<N(用元素符号表示).
(2)D元素的原子核外共有12种不同运动状态的电子、4种不同能级的电子.
(3)写出E的基态原子的电子排布式:1s22s22p63s23p64s2.
(4)F和X(质子数为25)两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态.
| 元素 | X | F | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
13.下列有关实验的说法正确的是( )
| A. | 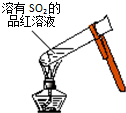 加热后溶液颜色变为无色 加热后溶液颜色变为无色 | |
| B. | 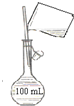 配制100 mL 0.10 mol•L-1NaCl溶液 配制100 mL 0.10 mol•L-1NaCl溶液 | |
| C. | 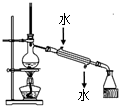 实验室用该装置制取少量蒸馏水 实验室用该装置制取少量蒸馏水 | |
| D. | 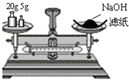 称量25 g NaOH 称量25 g NaOH |




 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: