题目内容
20.下列溶液中,Na+物质的量浓度最大的是( )| A. | 10 mL 0.4 mo l•L-1 NaOH溶液 | B. | 5 mL 0.3 mo l•L-1 Na3PO4溶液 | ||
| C. | 10 mL 0.3 mo l•L-1 Na2SO4溶液 | D. | 5 mL 0.5 mol•L-1 NaNO3溶液 |
分析 钠离子的物质的量浓度与溶液体积大小无关,与溶质化学式组成、溶质的物质的量浓度有关,据此对各选项进行判断.
解答 解:A.10 mL 0.4 mo l•L-1 NaOH溶液中钠离子浓度为:c(Na+)=0.4mol•L-1;
B.5 mL 0.3 mo l•L-1 Na3PO4溶液中钠离子浓度为:c(Na+)=0.3×3mol•L-1=0.9mol•L-1;
C.10 mL 0.3 mo l•L-1 Na2SO4溶液中钠离子的物质的量浓度为:c(Na+)=0.3×2mol•L-1=0.6mol•L-1;
D.5mL mL 0.5 mol•L-1 NaNO3溶液中钠离子浓度为:c(Na+)=0.5mol•L-1,
综上所述钠离子浓度最大的为B,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意离子浓度与溶液体积大小无关,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
4.下列变化过程中极性共价键被破坏的是( )
| A. | 钨的升华 | B. | 硅的熔化 | C. | 溴化氢溶于水 | D. | 食盐的溶解 |
8.铁触媒(铁的某氧化物)是工业合成氨的催化剂.某同学设计了以下两种方案研究铁触媒的组成.
方案一:用下列流程测定铁触媒的含铁量,确定其组成.

(1)步骤④后面需用酸式滴定管(填仪器名称)取25.00mL稀释后溶液.
(2)因为通入Cl2不足量,“溶液B”中还含有FeCl2 或者FeSO4或者Fe2+会影响测定结果.
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2.请设计实验方案检验Cl2,完成下列实验报告.限选试剂:0.1mol•L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL•L-1KSCN溶液.
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成.

(4)“干燥管C”的作用是防止空气中的CO2和水蒸气进入B中.
(5)称取15.2g铁触媒进行上述实验.充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为Fe4O5或2FeO•Fe2O3.(相对原子质量:C-12 O-16 Fe-56)
方案一:用下列流程测定铁触媒的含铁量,确定其组成.

(1)步骤④后面需用酸式滴定管(填仪器名称)取25.00mL稀释后溶液.
(2)因为通入Cl2不足量,“溶液B”中还含有FeCl2 或者FeSO4或者Fe2+会影响测定结果.
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2.请设计实验方案检验Cl2,完成下列实验报告.限选试剂:0.1mol•L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL•L-1KSCN溶液.
| 实验操作 | 实验现象与结论 |

(4)“干燥管C”的作用是防止空气中的CO2和水蒸气进入B中.
(5)称取15.2g铁触媒进行上述实验.充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为Fe4O5或2FeO•Fe2O3.(相对原子质量:C-12 O-16 Fe-56)
5.当光束通过下列分散系时,能形成一条光亮通路的是( )
| A. | 食盐水 | B. | 碘酒 | C. | 淀粉溶液 | D. | Fe(OH)3沉淀 |




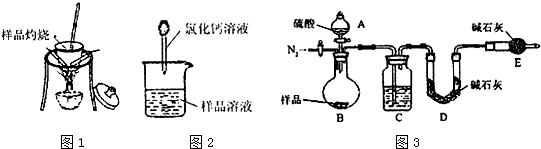
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: