题目内容
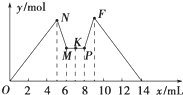 如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )| A、N点时溶液中的溶质只有NaCl |
| B、M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
| C、c(NaOH)=c(HCl) |
| D、原混合溶液中c(MgCl2):c(AlCl3)=1:1 |
考点:有关混合物反应的计算
专题:计算题
分析:A、在MgCl2和AlCl3的混合溶液中加入NaOH溶液,首先发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,至N点时Mg2+、Al3+恰好完全沉淀,溶液中的溶质只有NaCl;
B、接着Al(OH)3开始溶解:Al(OH)3+OH-═AlO-+2H2O,至x=6时(M点)Al(OH)3恰好完全溶解,x在6~8之间时沉淀量不变,说明M点时仍在加入NaOH溶液;
C、x=8时(P点),又产生沉淀:AlO-+H++H2O═Al(OH)3↓,说明加入的盐酸与NaOH反应后有剩余,至x=9时(F点),AlO恰好完全转化为Al(OH)3沉淀,用去盐酸1mL,又知在NM段,溶解Al(OH)3需要1mLNaOH溶液,故c(NaOH)=c(HCl);
D、沉淀Al3+需要消耗3mLNaOH溶液,则沉淀Mg2+所消耗的NaOH溶液为2mL,因此c(MgCl2):c(AlCl3)=1:1.
B、接着Al(OH)3开始溶解:Al(OH)3+OH-═AlO-+2H2O,至x=6时(M点)Al(OH)3恰好完全溶解,x在6~8之间时沉淀量不变,说明M点时仍在加入NaOH溶液;
C、x=8时(P点),又产生沉淀:AlO-+H++H2O═Al(OH)3↓,说明加入的盐酸与NaOH反应后有剩余,至x=9时(F点),AlO恰好完全转化为Al(OH)3沉淀,用去盐酸1mL,又知在NM段,溶解Al(OH)3需要1mLNaOH溶液,故c(NaOH)=c(HCl);
D、沉淀Al3+需要消耗3mLNaOH溶液,则沉淀Mg2+所消耗的NaOH溶液为2mL,因此c(MgCl2):c(AlCl3)=1:1.
解答:
解:A、在MgCl2和AlCl3的混合溶液中加入NaOH溶液,首先发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,至N点时Mg2+、Al3+恰好完全沉淀,溶液中的溶质只有NaCl,故A正确;
B、接着Al(OH)3开始溶解:Al(OH)3+OH-═AlO-+2H2O,至x=6时(M点)Al(OH)3恰好完全溶解,x在6~8之间时沉淀量不变,说明M点时仍在加入NaOH溶液,故B错误;
C、x=8时(P点),又产生沉淀:AlO-+H++H2O═Al(OH)3↓,说明加入的盐酸与NaOH反应后有剩余,至x=9时(F点),AlO恰好完全转化为Al(OH)3沉淀,用去盐酸1mL,又知在NM段,溶解Al(OH)3需要1mLNaOH溶液,故c(NaOH)=c(HCl),故C正确;
D、因为沉淀Al3+需要消耗3mLNaOH溶液,则沉淀Mg2+所消耗的NaOH溶液为2mL,因此c(MgCl2):c(AlCl3)=1:1,故D正确.
故选:B.
B、接着Al(OH)3开始溶解:Al(OH)3+OH-═AlO-+2H2O,至x=6时(M点)Al(OH)3恰好完全溶解,x在6~8之间时沉淀量不变,说明M点时仍在加入NaOH溶液,故B错误;
C、x=8时(P点),又产生沉淀:AlO-+H++H2O═Al(OH)3↓,说明加入的盐酸与NaOH反应后有剩余,至x=9时(F点),AlO恰好完全转化为Al(OH)3沉淀,用去盐酸1mL,又知在NM段,溶解Al(OH)3需要1mLNaOH溶液,故c(NaOH)=c(HCl),故C正确;
D、因为沉淀Al3+需要消耗3mLNaOH溶液,则沉淀Mg2+所消耗的NaOH溶液为2mL,因此c(MgCl2):c(AlCl3)=1:1,故D正确.
故选:B.
点评:本题考查了MgCl2和AlCl3溶液与酸碱的关系,理清反应的整个过程,问题即可解决,可以利用方程式计算,也可以用原子守恒计算.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
甲烷分子呈正四面体型,下列有关叙述不能说明甲烷分子为正四面体型的是( )
| A、甲烷分子中任意三个H原子都构成正三角形 |
| B、二氯甲烷无同分异构体 |
| C、甲烷分子中四个C-H键的键长、键能、键角都相等 |
| D、丙烷无同分异构体 |
将16mL NO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3?5N2+6H2O(g).已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是 ( )
①3:1②3:2③3:3 ④3:4⑤3:5.
①3:1②3:2③3:3 ④3:4⑤3:5.
| A、①② | B、①⑤ | C、②③④ | D、④⑤ |
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该有机物属于烃 |
| B、该化合物中碳、氢原子个数比为1:4 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定不含有氧元素 |
利用如图所示实验装置测定气体摩尔体积,所用药品为1g锌粒和10mL 0.5mol?L-1硫酸溶液,相关叙述正确的是( )


| A、实验时,将硫酸溶液倾斜倒入锌粒中 |
| B、实验时,量气管压入漏斗的水过多而溢出,不影响实验 |
| C、实验时,待体系温度降低到0℃时方可进行读数 |
| D、实验时,用CCl4代替水,测得氢气的体积更准确 |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、无色溶液:Ca2+、H+、Cl-、HSO3 - | ||
| B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3 - | ||
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3 - | ||
D、
|
 如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度
如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线.下列有关该反应的描述正确的是( )
| A、该反应的过程是熵减小的过程 |
| B、若降低温度,v正减小,v逆增大 |
| C、第6min后,反应就停止了 |
| D、X在第一分钟和第二分钟内的平均反应速率之比是3:2 |
下列叙述正确的是( )
| A、无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)?c(OH-)=1×10-14 |
| B、c(H+)等于1×10-7mol?L-1的溶液一定是中性溶液 |
| C、0.2 mol?L-1CH3COOH溶液中的c(H+)是0.1 mol?L-1CH3COOH溶液中的c(H+)的2倍 |
| D、任何浓度的溶液都可以用pH来表示其酸性的强弱 |