题目内容
下列表中括号内的物质为所含的少量杂质,请选用一种最佳试剂和最简分离装置将杂质除去.将所选试剂的序号及装置的编号填入表中.
试剂:①水 ②NaOH ③溴水 ④CaO ⑤酸性高锰酸钾溶液
分离装置:a.分液装置 b.过滤装置 c.蒸馏装置 d.洗气装置
试剂:①水 ②NaOH ③溴水 ④CaO ⑤酸性高锰酸钾溶液
分离装置:a.分液装置 b.过滤装置 c.蒸馏装置 d.洗气装置
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | ||
| 溴苯(液溴) | ||
| 苯(苯酚) | ||
| 乙醇(水) |
考点:物质分离、提纯的实验方案设计,乙烯的化学性质,苯的性质,乙醇的化学性质,苯酚的化学性质
专题:有机物的化学性质及推断
分析:除去乙烷中的乙烯,可通过溴水,用洗气的方法分离;
除去溴苯中的溴,可加入氢氧化钠溶液,然后用分液的方法分离;
除去苯中的苯酚,可加入氢氧化钠溶液,然后用分液的方法分离;
除去乙醇中的水,可用蒸馏的方法分离.
除去溴苯中的溴,可加入氢氧化钠溶液,然后用分液的方法分离;
除去苯中的苯酚,可加入氢氧化钠溶液,然后用分液的方法分离;
除去乙醇中的水,可用蒸馏的方法分离.
解答:
解:乙烯可与溴发生加成反应,除去乙烷中的乙烯,可通过溴水,用洗气的方法分离;
溴和与氢氧化钠反应,除去溴苯中的溴,可加入氢氧化钠溶液,然后用分液的方法分离;
苯酚和氢氧化钠反应生成苯酚钠和水,除去苯中的苯酚,可加入氢氧化钠溶液,然后用分液的方法分离;
乙醇和水的沸点不同,可加入生石灰吸收水,然后蒸馏,
故答案为:
溴和与氢氧化钠反应,除去溴苯中的溴,可加入氢氧化钠溶液,然后用分液的方法分离;
苯酚和氢氧化钠反应生成苯酚钠和水,除去苯中的苯酚,可加入氢氧化钠溶液,然后用分液的方法分离;
乙醇和水的沸点不同,可加入生石灰吸收水,然后蒸馏,
故答案为:
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | 溴水 | 洗气 |
| 溴苯(液溴) | 氢氧化钠溶液 | 分液 |
| 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| 乙醇(水) | 生石灰 | 蒸馏 |
点评:本题考查物质的分离、提纯知识,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意根据物质的性质的异同选择实验方法,学习中要注重相关知识的积累.

练习册系列答案
相关题目
下列有关官能团的叙述错误的是( )
| A、不同类的有机物可以有相同的官能团 |
| B、醚类的官能团是醚键 |
| C、所有的烷烃和芳香烃都没有官能团 |
| D、同一有机物可以含不同种官能团 |
实验室里取用金属钠时,用到的仪器用品是( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤试管 ⑥玻璃棒 ⑦药匙 ⑧玻璃片或培养皿.
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤试管 ⑥玻璃棒 ⑦药匙 ⑧玻璃片或培养皿.
| A、①③⑤⑦ | B、②④⑦⑧ |
| C、③④⑤⑧ | D、②③④⑧ |
下列各组括号内的试剂,不能用于除掉物质中杂质的是( )
| A、Fe粉中混有Al粉杂质(稀H2SO4) |
| B、FeCl3中混有FeCl2杂质(Cl2) |
| C、CO气体中混有CO2杂质(NaOH溶液) |
| D、SiO2中混有CaCO3杂质(盐酸) |
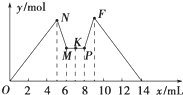 如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )| A、N点时溶液中的溶质只有NaCl |
| B、M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
| C、c(NaOH)=c(HCl) |
| D、原混合溶液中c(MgCl2):c(AlCl3)=1:1 |
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| B、c(ClO-)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(HCO3-)>c(ClO-)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
下列说法或表示法正确的是( )
| A、1mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B、由C(石墨)→C(金刚石)△H=+119 kJ?mol-1可知,石墨比金刚石稳定 |
| C、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| D、在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧产生的热量不相等 |


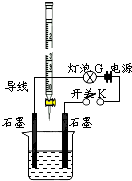 常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.