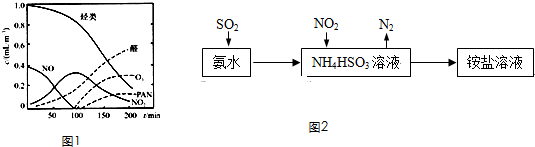
题目内容
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该有机物属于烃 |
| B、该化合物中碳、氢原子个数比为1:4 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定不含有氧元素 |
考点:有关有机物分子式确定的计算
专题:计算题
分析:化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,根据n=
计算二氧化碳、水的物质的量,进而计算有机物中C、H原子数目之比,根据m=nM计算C、H元素质量,根据质量守恒定律计算判断化合物中是否含有O元素.
| m |
| M |
解答:
解:化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,
8.8g二氧化碳的物质的量为
=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,
7.2g水的物质的量为
=0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,
故化合物中N(C):N(H)=0.2mol:0.4mol=1:4,
由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,
综上分析可知,ACD错误,B正确,
故选B.
8.8g二氧化碳的物质的量为
| 8.8g |
| 44g/mol |
7.2g水的物质的量为
| 7.2g |
| 18g/mol |
故化合物中N(C):N(H)=0.2mol:0.4mol=1:4,
由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,
综上分析可知,ACD错误,B正确,
故选B.
点评:本题考查有机物组成的确定,侧重考查质量守恒定律,题目难度不大,注意根据质量守恒判断是否含有氧元素.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
有甲基、苯基、羟基、羧基两两结合(包括自身)的物质中,具有酸性的有机物种类有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
可用来提取含有杂质Br2的溴苯的试剂是( )
| A、水 | B、酒精 |
| C、NaOH溶液 | D、苯 |
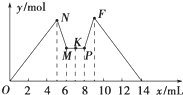 如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )| A、N点时溶液中的溶质只有NaCl |
| B、M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
| C、c(NaOH)=c(HCl) |
| D、原混合溶液中c(MgCl2):c(AlCl3)=1:1 |
同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是( )
| A、反应速率HCl>CH3COOH |
| B、气泡逸出速率CH3COOH>HCl |
| C、在相同条件下两酸产生的CO2的体积不相同 |
| D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH |
下列沸点最高的是( )
| A、正戊烷 | B、异戊烷 |
| C、丁烷 | D、丙烷 |
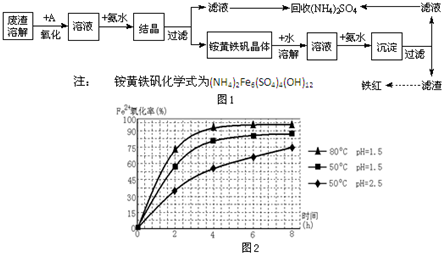 工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1:
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1: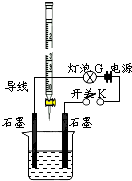 常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.